Химическая энциклопедия
"БОРАТЫ НЕОРГАНИЧЕСКИЕ"
Главная - Химическая энциклопедия - буква Б - БОРАТЫ НЕОРГАНИЧЕСКИЕ
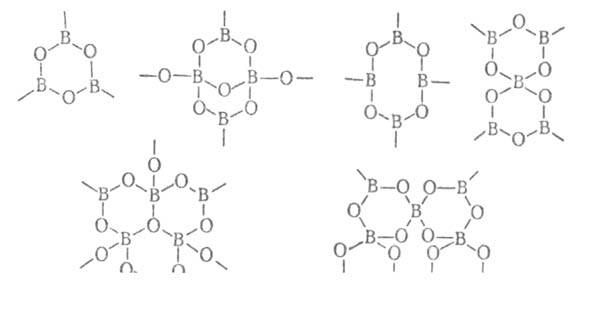
БОРАТЫ НЕОРГАНИЧЕСКИЕ (оксобораты), соли борных к-т: метаборной НВО2, ортоборной Н3ВО3 и не выделенных в своб. состоянии полиборных Н3m-2nВmO3m-n. По числу атомов бора в молекуле делятся на моно-, ди-, тетра-, гексабораты и т.д. Бораты (Б.) называют также по образующим их к-там и по числу молей В2О3, приходящемуся на 1 моль основного оксида. Так, разл. метабораты м. б. названы моноборатами, если содержат анион В(ОН)4 или цепочечный анион {BO2}nn-, диборатами - если _содержат цепочечный сдвоенный анион {В2О3(ОН)2}n2n-, триборатами - если содержат кольцевой анион (В3О)63-. Структуры Б. включают борокислородные группировки - "блоки", содержащие
от 1 до 6, а иногда и 9 атомов В, напр.:
Координационное число атомов В 3 (борокислородные треугольные группировки) или 4 (тетраэдрич. группировки). Борокислородные группировки - основа не только островных, но и более сложных структур - цепочечных, слоистых и каркасных полимеризованных. Последние образуются в результате отщепления воды в молекулах гидратированных Б. и возникновения мостиковых связей через атомы О; процесс иногда сопровождается разрывом связей В—О внутри полианионов. Полианионы могут присоединять боковые группы - борокислородные тетраэдры или треугольники, их димеры или посторонние анионы. Аммоний, щелочные, а также и другие металлы в степени окисления + 1 образуют чаще всего гидратированные и безводные метабораты типа МВО2, тетрабораты М2В4О7, пентабораты МВ5О8, а также декабораты М4В10О17*nН2О. Щел.-зем. и др. металлы в степени окисления +2 дают обычно гидратированные метабораты, трибораты М2В6ОП и гексабораты МВ6О10, а также безводные мета-, орто- и тетрабораты. Для металлов в степени окисления + 3 характерны гидратированные и безводные ортобораты МВО3. Известно большое число смешанных Б., напр. октабораты М2IМIIВ8О11*nН2О, а также Б. с включением др. анионов - гетерополибораты, из к-рых наиб. важны соед. типа борацита М3II(В7O13)Х (Х - галоген, ОН, NO2- и др.). Б.-бесцв. аморфные в-ва или кристаллы (в осн. с низкосимметричной структурой - моноклинной или ромбической). Для безводных Б. т-ры плавления находятся в интервале от 500 до 2000°С; наиб. высокоплавки метабораты щелочных и орто- и метабораты щел.-зем. металлов (см. табл.). Большинство Б. при охлаждении их расплавов легко образует стекла. Твердость гидратированных Б. по шкале Мооса 2-5, безводных - до 9. СВОЙСТВА НЕОРГАНИЧЕСКИХ БОРАТОВ
Гидратированные монобораты теряют кристаллизационную воду до ~180°С, полибораты - при 300-500°С; отщепление воды за счет групп ОН, координированных вокруг атомов В, происходит до ~750°С. При полном обезвоживании образуются аморфные в-ва, к-рые при 500-800 °С в большинстве случаев претерпевают "боратовую перегруппировку" - кристаллизацию, сопровождающуюся (для полиборатов) частичным разложением с выделением В2О3. Б. щелочных металлов, аммония и Т1(1) раств. в воде (особенно мета- и пентабораты), в водных р-рах гидролизуются (р-ры имеют щелочную р-цию). Большинство Б. легко разлагается к-тами, в нек-рых случаях - при действии СО2 и SO2. Бораты щел.-зем. и тяжелых металлов взаимод. с р-рами щелочей, карбонатов и гидрокарбонатов щелочных металлов. Безводные Б. химически более стойки, чем гидратированные. С нек-рыми спиртами, в частности с глицерином, Б. образуют р-римые в воде комплексы. При действии сильных окислителей, в частности Н2О2, или при электрохим. окислении Б. превращаются в пероксобораты . Известно ок. 100 природных Б., являющихся в осн. солями Na, Mg, Ca, Fe; важнейшие из них приведены в таблице. Гидратированные Б. получают: нейтрализацией Н3ВО3 оксидами, гидроксидами или карбонатами металлов; обменными р-циями Б. щелочных металлов, чаще всего Na, с солями др. металлов; р-цией взаимного превращения малорастворимых Б. с водными р-рами Б. щелочных металлов; гидротермальными процессами с использованием галогенидов щелочных металлов в кач-ве минерализующих добавок. Безводные Б. получают сплавлением или спеканием В2О3 с оксидами или карбонатами металлов или обезвоживанием гидратов; монокристаллы выращивают в р-рах Б. в расплавл. оксидах, напр. Bi2O3. Б. используют: для получения др. соед. В; как компоненты шихты при произ-ве стекол, глазурей, эмалей, керамики; для огнестойких покрытий и пропиток; как компоненты флюсов для рафинирования, сварки и пайки металлов; в кач-ве пигментов и наполнителей лакокрасочных материалов; как протравы при крашении, ингибиторы коррозии, компоненты электролитов, люминофоров и др. Наиб, применение находят бура (см. Натрия бораты )и кальция бораты . См. также Борные руды . Б. малотоксичны. ПДК в питьевой воде 1 мг/л в пересчете на В2О3 (по данным США). Лит.: Изучение высокотемпературных боратов, М., 1970; Годе Г. К., Синтезы боратов, ч. 1-2, Рига, 1971-72; Горбов А. Ф., Геохимия бора, Л., 1976; Бораты и боратные системы, Рига, 1978; Исследование синтетических боратов, Рига, 1981; Леонюк Н.И., Леонюк Л.И., Криста.похимия безводных боратов, М., 1983; Heller G, "Fortschritte chemischen Forschungen", 1970, Bd 15, H. 2, S. 206-80; Christ С L, Clark J. R., "Physics and Chemistry of Minerals", 1977, v. 2, N 1-2, p. 59-87. П.И. Федоров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: БОРАТЫ НЕОРГАНИЧЕСКИЕ
будет выглядеть так: Что такое БОРАТЫ НЕОРГАНИЧЕСКИЕ