Химическая энциклопедия
"АММОНИЯ ФТОРИД"
Главная - Химическая энциклопедия - буква А - АММОНИЯ ФТОРИД
АММОНИЯ ФТОРИД
NH4F, бесцв. кристаллы с гексагон.
решеткой типа вюрцита (а = 0,4439 нм, с = 0,7165 нм, z=2, пространств.
группа P6mc); т. разл. 167°С (до NH3 и NH4HF2);
плотн. 1,002 г/см3; Соp 65,27 Дж/(моль*К); А. ф.-фторирующий агент в произ-ве LiF, BeF2, A1F3 и др.; при получении HF через NaHF2; компонент р-ров для очистки котлов и труб от накипи, флюоритовых концентратов - от кварца и кальцита, компонент составов для травления полупроводников, стекла и нек-рых металлов, для гидротермального выращивания монокристаллов кварца и аметиста. А. ф. токсичен, ПДК 0,5 мг/м3 (в пересчете на HF). Гидродифторид аммония NH4HF2-бесцв. слабогигроскопичные
кристаллы с ромбич. решеткой (а = = 0,840 нм, b = 0,816 нм, с = 0,367 нм, z = 4, пространств. группа Ртап); т. пл. 126,45°С,
т. кип. ок. 238 °С (с разл.); плотн. 1,505 г/см3 (20°С); С°р106,6
ДжДмоль*К); Известны также тригидротетрафторид аммония NH4H3F4 (т. пл. 23,4°С) и пентагидрогексофторид NH4H,F6 (т. пл.-7,8°С), разлагающиеся выше 20°С до NH4HF2 и HF. Лит.: Раков Э. Г, Мельниченко Е. И., "Успехи химии", 1984, т.
53, в. 9, с- 1463-92. э. Г. Раков.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: АММОНИЯ ФТОРИД
будет выглядеть так: Что такое АММОНИЯ ФТОРИД
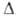 H°обр-465,9 кДж/моль; Sо298 71,96 Дж/(моль*К);
раств. в воде (45,38% при 25°С), при - 27,4 °С образует моногидрат, ниже
0°С - твердые р-ры со льдом; при нагр. водных р-ров разлагается с выделением
NH3; плохо раств. в орг. р-рителях, очень хорошо-в жидком HF.
С NH4HF2 образует эвтектику (т. пл. 109,3°С), с мн.
элементами, оксидами и солями - фторо- или оксофторометаллаты аммония.
Получают взаимод. газообразных NH3 и HF или их водных р-ров,
а также по р-ции:
H°обр-465,9 кДж/моль; Sо298 71,96 Дж/(моль*К);
раств. в воде (45,38% при 25°С), при - 27,4 °С образует моногидрат, ниже
0°С - твердые р-ры со льдом; при нагр. водных р-ров разлагается с выделением
NH3; плохо раств. в орг. р-рителях, очень хорошо-в жидком HF.
С NH4HF2 образует эвтектику (т. пл. 109,3°С), с мн.
элементами, оксидами и солями - фторо- или оксофторометаллаты аммония.
Получают взаимод. газообразных NH3 и HF или их водных р-ров,
а также по р-ции:
 Нопл19,1
кДж/моль,
Нопл19,1
кДж/моль, Hоисп
ок. 188 кДж/моль,
Hоисп
ок. 188 кДж/моль, Нообр-804
кДж/моль; Sо298 115,51 ДжДмоль*К); раств.
в воде (41,5% при 25°С) и жидком HF, не раств. в этаноле и ацетоне. Получают
гидродифторид взаимод. газообразных HF и NH3 или их водных р-ров;
техн. смесь NH4HF2 с NH4F (ок. 25%) -
выпариванием водных р-ров NH4F. Используют аналогично NH4F
и, кроме того, как электролит при получении NF3.
Нообр-804
кДж/моль; Sо298 115,51 ДжДмоль*К); раств.
в воде (41,5% при 25°С) и жидком HF, не раств. в этаноле и ацетоне. Получают
гидродифторид взаимод. газообразных HF и NH3 или их водных р-ров;
техн. смесь NH4HF2 с NH4F (ок. 25%) -
выпариванием водных р-ров NH4F. Используют аналогично NH4F
и, кроме того, как электролит при получении NF3.