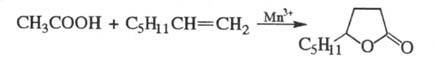Химическая энциклопедия
"УКСУСНАЯ КИСЛОТА"
Главная - Химическая энциклопедия - буква У - УКСУСНАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА
(этановая
к-та) CH3COOH, мол. м. 60,05; бесцв. прозрачная жидкость с резким
запахом. Для безводной ("ледяной") т. пл. 16,64 0C, т.
кип. 117,8 0C; ХАРАКТЕРИСТИКА АЗЕОТРОПНЫХ
СМЕСЕЙ УКСУСНОЙ КИСЛОТЫ
Образует тройные азеотропные
смеси с водой и бензолом, т. кип. 88 0C, с водой и бутилацетатом,
т. кип. 89 0C. В природе У. к. распространена
в своб. виде или в виде солей и сложных эфиров в растениях (в зеленых листьях),
в выделениях животных (моче, желчи), образуется при гниении и брожении (в кислом
молоке, сыре, вине). Брожение происходит под влиянием специфич. бактерий "уксусного
грибка". По хим. св-вам У. к.- типичная
карбоновая кислота
. Соли и эфиры У. к. наз. ацетатами. При взаимодействии
У. к. с этиленом в зависимости от условий р-ции образуются этил-ацетат (кислые
кат.), винилацетат CH3COOCH = CH2 (кат.-Pd - Li) либо
диацетат этиленгликоля (СН3СООСН2)2 (кат.-TeO2
и HBr). Р-ция У. к. с более высокомол. олефинами в присут. солей Мn(III)
приводит к алкилбутиролактонам, напр.: С ацетиленом в присут.
солей Hg У. к. дает винилацетат, в присут. трет
-бутилпероксида - адипиновую
к-ту; с формальдегидом в присут. катализатора (напр., KOH на SiO2)
в паровой фазе - акриловую к-ту. У. к. растворяет мн. металлы,
их оксиды и карбонаты с образованием солей. Окислители ускоряют р-цию. Так,
Со легко раств. в У. к. в присут. Co(NO3)2 или H2O2. У. к.- один из главных
промежут. метаболитов, выполняющих как структурную, так и энергетич. функцию
в обмене в-в. Пром. способы получения
У. к. 1) Каталитич. окисление ацетальдегида в жидкой фазе в присут. солей Mn
или смеси солей Mn, Со, Ni и Fe при 56-75 0С и давлении 0,2-0,3 МПа;
окислитель - техн. O2, степень конверсии более 95%, выход У. к. 92-93%.
Окисление ацетальдегида O2 воздуха в присут. катализатора, состоящего
из смеси ацетатов Со и Cu, при 50-60 0C дает смесь У. к. и уксусного
ангидрида в соотношении (45:55), степень конверсии 16-18%, выход (по сумме продуктов)
94-96%. Выделение и очистку У. к. производят ректификацией. 2) Жидкофазное окисление
воздухом углеводородных фракций нефти C5-C6 при 140-180
0C и давлении 5-8 МПа; наряду с У. к. получают муравьиную (15% по
массе от суммы продуктов) и пропионовую к-ты (7-8%). 3) Каталитич. карбонилирование
метанола в присут. комплексных соед. Rh при 185 С и давлении 2,8 МПа. Конверсия
метанола близка к 100%, конверсия СО - 86%. 4) Уксуснокислое брожение
этанола (пищ. У. к.). 5) Пиролиз древесины (наряду
с метанолом и ацетоном). В лаборатории безводную У. к. получают перегонкой сухого
CH3COONa и H2SO4. У. к.- сырье в произ-ве
уксусного ангидрида, ацетилхлори-да, монохлоруксусной к-ты, ацетатов, MH. красителей,
инсектицидов, лек. ср-в (аспирин, фенацетин); используют в пищ. пром-сти в изготовлении
приправ, маринадов, консервов в виде столового уксуса - 3-15%-ный водный р-р
и уксусной эссенции - 80%-ный водный р-р пищевой У. к. У. к.- р-ритель лаков,
коагулянт латекса, ацетилирующий агент в орг. синтезе. Соли У. к. (Fe, Al, Cr
и др.) - протравы при крашении. Пары У. к. раздражают слизистые
оболочки верх, дыхат. путей, р-ры (концентрация выше 30% по массе) при соприкосновении
с кожей вызывают ожоги. T. всп. 38 0C, т. само-воспл. 454 0C,
КПВ 3,3-22% (по объему), температурные пределы взрываемости 35-76 0C.
ПДК в атм. воздухе 0,06 мг/м3, в воздухе рабочей зоны 5 мг/м3. Мировой объем произ-ва
3,5 млн. т/год (1990), в т.ч. США - 1,2, Япония - 0,33, Германия - 0,31. Лит.: Рид Р., Праусниц
Дж., Шервуд Т., Свойства газов и жидкостей, пер. с англ., 3 изд., Л., 1982;
Kirk - Othmer encyclopedia, 3 ed., v. 1, N. Y., 1978, p. 124-47. 3.
П. Присяжнюк. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: УКСУСНАЯ КИСЛОТА
будет выглядеть так: Что такое УКСУСНАЯ КИСЛОТА
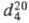 1,0492;
1,0492; 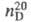 1,3715; ркрит 57,85 кПа, tкрит 321,6
0C,
1,3715; ркрит 57,85 кПа, tкрит 321,6
0C,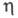 11,83 мПа·с (20 0C),
11,83 мПа·с (20 0C),
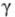 27,57 мН/м,
27,57 мН/м,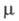 5,6·10-30
Кл·м; ур-ние температурной зависимости давления пара (мм рт. ст.): lg p
= 7,55716 - 1642,547(233,386 + t);
5,6·10-30
Кл·м; ур-ние температурной зависимости давления пара (мм рт. ст.): lg p
= 7,55716 - 1642,547(233,386 + t); 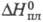 195,7 кДж/моль,
195,7 кДж/моль, 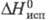 24,4 кДж/моль,
24,4 кДж/моль, 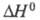 растворения 1,902 кДж/моль,
растворения 1,902 кДж/моль, 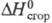 -208,2 кДж/моль,
-208,2 кДж/моль, 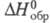 -493,16 (жидкость) и -471,8 кДж/моль (пар); рКа 4,76 (25 0C).
Существует в виде димеров циклич. и линейной структуры. Смешивается со мн. р-рителями,
хорошо растворяет орг. соединения, в ней раств. газы HF, HCl, HBr, HI и др.,
гигроскопична. Образует азео-тропные смеси (см. табл.).
-493,16 (жидкость) и -471,8 кДж/моль (пар); рКа 4,76 (25 0C).
Существует в виде димеров циклич. и линейной структуры. Смешивается со мн. р-рителями,
хорошо растворяет орг. соединения, в ней раств. газы HF, HCl, HBr, HI и др.,
гигроскопична. Образует азео-тропные смеси (см. табл.).