Химическая энциклопедия
"ТРИМОЛЕКУЛИРНЫЕ РЕАКЦИИ"
Главная - Химическая энциклопедия - буква Т - ТРИМОЛЕКУЛИРНЫЕ РЕАКЦИИ
ТРИМОЛЕКУЛИРНЫЕ РЕАКЦИИ
,
элементарные р-ции, в к-рых химически изменяются три молекулы. Скорость
Т. р. w равна среднему числу n3 групп из трех частиц
А, В, С, сосредоточенных в нек-ром эффективном объеме u действия
межмол. сил, умноженному на вероятность w осуществления р-ции в такой группе
в единицу времени: w = n3w. В рамках представлений
формальной хим. кинетики п3 = = (u/V)2nАnBnC,
u = 4pd3/3, где V-объем системы, nА,
пB, пC- числа частиц А, В, С в этом
объеме, d ! 0,1 нм-эффективный диаметр частиц. Константа скорости
р-ции k = = (u/V1)2w, где
V1 = 1 см3. Если в результате Т. р.
образуется не менее двух частиц (напр., NO + NO + Cl2 : 2NOCl),
макс. значение вероятности р-ции wмакс определяется временем
т ухода продуктов из объема u: где Множитель А (Т)может
существенно возрасти, если к.-л. пары разноименных частиц А, В, С образуют долгоживущие
комплексы, в к-рых исходные частицы, сохраняя свою хим. индивидуальность, состав
и строение, удерживаются межмол. силами типа ван-дер-ваальсовых. Необходимые
условия образования таких комплексов след.: 1) отношение энергии связи e
частиц в комплексе удовлетворяет условию: ехр(e/RТ) Иногда к Т. р. относят
р-ции рекомбинации типа А + В + + М:АВ + М, в к-рых частица М не
изменяется и играет лишь роль катализатора, переводящего нестабильную пару сталкивающихся
частиц А и В в стабильную молекулу АВ. Лит.: Кондратьев
В. Н., Константы скорости газофазных реакций. Справочник, М., 1970. Н. М.
Кузнецов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТРИМОЛЕКУЛИРНЫЕ РЕАКЦИИ
будет выглядеть так: Что такое ТРИМОЛЕКУЛИРНЫЕ РЕАКЦИИ

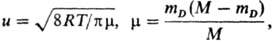 mD-мол. масса легчайшей
из частиц-продуктов, М = mA + mB +
mC-суммарная мол. масса реагирующих частиц, R-газовая
постоянная, Т-абс. т-ра. Если же в результате Т. р. образуется одна молекула
ABC, то wмакс определяется временем, в течение к-рого группа
из трех несвязанных частиц стабилизируется путем столкновения с четвертой частицей.
В этом случае при сравнимых массах всех трех частиц, равных, напр., mА,
wмакс также м.б. выражена ф-лой (1), но m!mА.
Порядок величины (u/V1)2wмакс
составляет 10-31 — 10-33 см6/с, т.е. 1012
- 1010 см6/(моль2·с). В общем случае для любой
Т. р. w = wмаксРехр(—E/RT), а константу
скорости можно выразить ур-нием Аррениуса k = A(T)exp(-E/RT),
где A(Т) = (u/V1)2wмакс,
mD-мол. масса легчайшей
из частиц-продуктов, М = mA + mB +
mC-суммарная мол. масса реагирующих частиц, R-газовая
постоянная, Т-абс. т-ра. Если же в результате Т. р. образуется одна молекула
ABC, то wмакс определяется временем, в течение к-рого группа
из трех несвязанных частиц стабилизируется путем столкновения с четвертой частицей.
В этом случае при сравнимых массах всех трех частиц, равных, напр., mА,
wмакс также м.б. выражена ф-лой (1), но m!mА.
Порядок величины (u/V1)2wмакс
составляет 10-31 — 10-33 см6/с, т.е. 1012
- 1010 см6/(моль2·с). В общем случае для любой
Т. р. w = wмаксРехр(—E/RT), а константу
скорости можно выразить ур-нием Аррениуса k = A(T)exp(-E/RT),
где A(Т) = (u/V1)2wмакс,
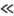 1
суть стерич. фактор, выражающий весьма малую вероятность образования активир.
комплекса при произвольной ориентации сталкивающихся частиц. Для Т. p. NO +
NO + Сl2 : 2NOC1 экспериментально определенная константа скорости
k = 10-35,08b0,37ехр[(-22 кДж/моль)/RT]см6/с.
1
суть стерич. фактор, выражающий весьма малую вероятность образования активир.
комплекса при произвольной ориентации сталкивающихся частиц. Для Т. p. NO +
NO + Сl2 : 2NOC1 экспериментально определенная константа скорости
k = 10-35,08b0,37ехр[(-22 кДж/моль)/RT]см6/с.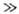 1;
2) по крайней мере одна из двух частиц комплекса не является одноатомной.
1;
2) по крайней мере одна из двух частиц комплекса не является одноатомной.