Химическая энциклопедия
"ТИТАНА ХЛОРИДЫ"
Главная - Химическая энциклопедия - буква Т - ТИТАНА ХЛОРИДЫ
ТИТАНА ХЛОРИДЫ
. Тетрахлорид
ТiCl4-бесцв. прозрачная жидкость, дымящая на воздухе (см. табл.);
ур-ния температурной зависимости: плотности d= 1,7609--0,00166t
- 8,1 · 10-7t2 + 1,58· 10-9t3
г/см3 (от -22 до 135 °С), давления пара lgp(мм рт.ст.)
= 7,682 - 1964/T(249-409 К); в парах не диссоциирует и не разлагается
вплоть до высоких т-р; tкрит 365 °С, pкрит
5,01 МПа. Выше 500-600 °С окисляется О2 воздуха до ТiO2,
в присут. паров воды образуются также оксихлориды TiOCl2, Ti2O3Cl2.
Бурно реагирует с водой с получением ТiO2·nН2О,
в качестве промежут. продуктов образуются гидрат TiCl4·5H2O
и гидроксохлориды Ti(OH)nCl4_n·xH2O.
При очень медленном добавлении воды с тщательным перемешиванием и охлаждением
можно получить устойчивые конц. р-ры TiCl4. Раств. в этаноле и диэтиловом
эфире. С парами воды при 300-400 °С дает ТiO2. Восстанавливается
Н2 и активными металлами до TiCl2 и TiCl3,
затем-до Ti. TiCl4 раств.
Сl2 (7,6% по массе при 20 °С), незначительно-НСl. Смешивается
во всех соотношениях с жидким НС1, а также с хлоридами Sn, С, Si. Раств. в соляной
к-те при пропускании газообразного НСl с получением ярко-желтого р-ра гексахлортитановой
к-ты H2TiCl6. С разб. H2SO4 образует
TiOSO4, с конц. H2SO4-TiCl2SO4. 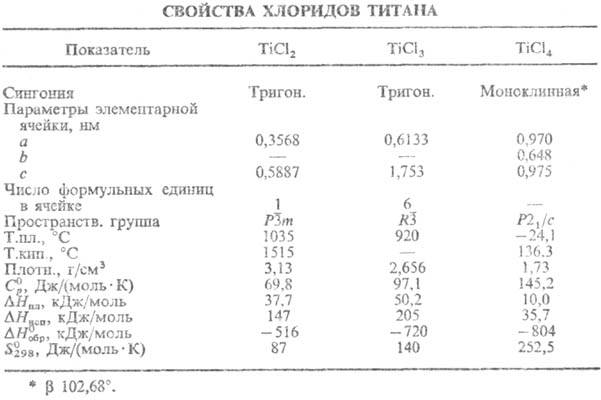
Получают TiCl4
хлорированием титановых шлаков, ру-тиловых концентратов или др. оксидных материалов
в при-сут. восстановителя (кокса) хлором. Процесс ведут либо в шахтных печах
при 800-1150 °С, либо в хлораторах с расплавом солей (смесь КС1 + NaCl,
отработанный расплав произ-ва Mg) при 750-800 °С, либо в печах кипящего
слоя при 500-600 °С. Очищают фильтрованием, гидролизом с помощью увлажненного
NaCl (удаление As), восстановлением Сu, Аl или H2S (удаление V, S,
Сr, орг. соед.), дистилляцией и ректификацией. Для получения TiCl4
высокой чистоты используют ректификацию и адсорбцию примесей на силикагеле.
Предложена также противоточная кристаллизация в колонне. Используют TiCl4
для получения Ti, TiO2, а также катализаторов (полимеризации этилена
и пропилена, алкилирования ароматич. углеводородов и др.), как дымообразователь. TiCl4 поражает
слизистые оболочки верх. дыхат. путей и рта, роговицу глаз, вызывает бронхит,
ожоги кожи; ПДК 1 мг/м3. Трихлорид TiCl3-темно-фиолетовые
или черные кристаллы; известно неск. политипов, а также коричневая b-мо-дификация
(образуется при восстановлении TiCl4 алкилалю-минием), к-рая после
отжига при 250-400 °С превращ. в фиолетовую модификацию; ур-ние температурной
зависимости давления пара: lgp(мм рт.ст.) = 21,47-9620/T+ + 3,27
lgT (298-800 К); в парах присутствует в основном Ti2Cl6;
уже при 440 °С начинает диспропорционировать на TiCl2 и TiCl4.
Во влажном воздухе расплывается, быстро окисляется и гидролизуется. Сильный
восстановитель. Легко раств. в воде и этаноле с получением фиолетовых р-ров;
из водных р-ров м.б. выделены TiCl3 · 6Н2О, а также и
тетра-гидрат (зеленого цвета). Водные р-ры на свету постепенно окисляются и
обесцвечиваются. Получают TiCl3
восстановлением TiCl4 водородом (при ~ 800 °С), Ti (ок. 600 °С),
А1, Si. Используют как компонент катализаторов полимеризации олефинов. Р-ры
TiCl3 применяют в аналит. химии. ПДК в воде 0,1 мг/л (в пересчете
на Ti). Дихлорид TiCl2-коричневые
или черные кристаллы; ур-ние температурной зависимости давления пара: lgp
(мм рт. ст.) = 9,593 - 10230/Т (753-883 К); уже при 800-850 °С в
вакууме диспропорционирует на Ti и TiCl4; сильный восстановитель;
на воздухе окисляется, реагирует с водой, выделяя Н2, с метанолом
и этанолом; плохо раств. в CS2, CHCl3, диэтиловом эфире.
Получают восстановлением TiCl4 металлич. Ti, Аl, Н2
или диспропорцио-нированием TiCl3. Используют при анализе нитро-,
нитрозо- и др. орг. соединений. Т. х. образуют с хлоридами
щелочных металлов хлоро-титанаты(II, III, IV), TiCl2 и TiCl3
с КН3-адцукты. П. И. Федоров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТИТАНА ХЛОРИДЫ
будет выглядеть так: Что такое ТИТАНА ХЛОРИДЫ