Химическая энциклопедия
"ТИТАНА ОКСИДЫ"
Главная - Химическая энциклопедия - буква Т - ТИТАНА ОКСИДЫ
ТИТАНА ОКСИДЫ
. Известно
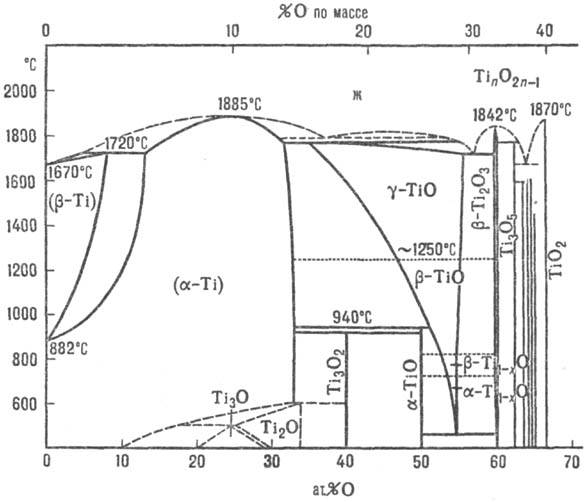
до 15 Т.о., св-ва важнейших приведены в табл., на рис. представлена диаграмма
состояния системы титан - кислород. Низшие Т.о.-продукты упорядочения
твердого р-ра О2 в a-Ti, макс. концентрация к-рого 31,9 ат.%
О. При длит. обжиге образуются фазы на основе Ti3O (20-30 ат.% О)
с ромбоэдрич. кристаллич. решеткой (при 25 ат.% О a = 0,51411, с = 0,95334 нм, пространств. группа Монооксид TiO-кристаллы
от золотисто-желтого до коричнево-фиолетового цвета со структурой типа NaCl
со статистич. распределением вакансий Ti и О; полиморфные переходы при 1250,
820 и 720 °С, при 940 °С образуется стехиометрич. низкотемпературная
моноклинная модификация (DH перехода 3,5 кДж/моль). TiO испаряется
конгруэнтно; ур-ние температурной зависимости давления пара: lgp (мм
рт.ст.) =11,46-28240/T (1921-1998 К); в воде не раств., раств. в разб.
соляной и серной к-тах; при нагр. на воздухе окисляется; получают взаимод. Ti
с ТiO2, компонент катализаторов. Гидроксид титана(II) Ti(OH)2
образуется при действии на р-ры солей Ti(II) водного р-ра NH3 или
солей слабых к-т в виде синего, коричневого или черного осадка, к-рый постепенно
светлеет из-за разложения на ТiO2 и Н2; сильный восстановитель;
легко раств. в к-тах; при нагр. на воздухе окисляется. Сесквиоксид Ti2O3-кристаллы
темно-фиолетового или черного цвета со структурой типа корунда; при 200 °С
превращ. в др. гексагон. модификацию; при испарении диссоциирует на TiO и ТiO2;
окисляется на воздухе только при очень высоких т-рах; с водой и минер. к-тами
не реагирует; раств. при нагр. в конц. H2SO4 с образованием
фиолетового р-ра Ti2(SO4)3; сплавляется с KHSO4
с получением титанилсульфатов K2TiO(SO4)2;
при спекании или сплавлении с оксидами или карбонатами щелочных, щел.-зем. и
др. металлов образует двойные оксиды.
Диаграмма состояния системы
титан-кислород (ж- жидкость). Гидроксид титана(III) Ti(OH)3
образуется при гидролизе солей Ti(III) или титанатов(III) в виде вишнево-красного,
коричневого, синего или черного осадка, к-рый постепенно белеет из-за окисления
водой, легко окисляется на воздухе, раств. в минер. к-тах. Оксид Ti3O5,
или В области от Ti1,75
до Ti1,9 существует гомологич. группа фаз TinO2n-
1,
где n = 4-9 (фазы Магнелли), кристаллизующиеся в триклинной решетке (пространств.
группа Диоксид ТiO2-бесцв.
кристаллы, при нагр. желтеет, но обесцвечивается после охлаждения; известен
в виде неск. модификаций; кроме рутила, анатаза и брукита, известных в виде
минералов, получены две модификации высокого давления: ромбич. IV (а
= 0,4531нм, b = 0,5498 нм, с = = 0,4900 нм, пространств. группа
Рbсп) при 4-12 ГПа и 400-1500°С, гексагон. V (а = 0,922
нм, с = 0,5685 нм) при давлении выше 25 ГПа. Брукит при всех условиях
метастабилен. При нагр. анатаз и брукит необратимо превращ. в рутил соотв. при
400-1000 °С и ~750°С. В основе структур этих модификаций октаэдры ТiO6.
Ур-ния температурной зависимости давления пара: для рутила lgp(мм рт.
ст.) = 10,97-29180/T(1850-2113 К), для жидкого lgp(мм рт.ст.)
= 9,03-25120/T (2113-2540 К); конгруэнтному испарению отвечает состав
ТiO1,87. TiO2 не раств.
в воде, разб. минер. к-тах (кроме плавиковой) и разб. р-рах щелочей. С Н2О2
образует ортотитано-вую к-ту Н4ТiO4 (желтого цвета). Медленно
раств. в конц. H2SO4, конц. р-рах щелочей, насыщ. р-ре
КНCO3. При нагр. с NH3 образует TiN. При сплавлении или
спекании с оксидами, карбонатами металлов образуются титанаты
и двойные
оксиды. Водородом, углеродом, активными металлами (Mg, Ca, Na) TiO2
при нагр. восстанавливается до низших оксидов.
С Сl2 при натр. в присут. восстановителей (угля) образует TiCl4. Получают TiO2
либо прокаливанием гидроксида, образующегося при гидролизе сульфатных р-ров
(при сульфатной переработке титановых концентратов), либо сжиганием TiCl4
(при 1200-1700 °С). ТiO2 высокой чистоты можно получить гидролизом
титанорг. соединений, Ti(OC4H9) с послед. прокаливанием.
Используют TiO2 как пигмент в лакокрасочной пром-сти (титановые белила),
в произ-ве бумаги, синтетич. волокон, пластмасс, резиновых изделий, в произ-ве
керамич. диэлектриков, белой эмали, термостойкого и оптич. стекла (в т.ч. для
волоконной оптики), как компонент обмазки электродов для электросварки и покрытий
литейных форм и т. д. Пыль TiO2 обладает
раздражающим действием, может вызвать бронхит, пневмосклероз и др. поражения
легких; ПДК в воздухе рабочей зоны 10 мг/м3, в атм. воздухе 0,5 мг/м3,
в воде 0,1 мг/л. Гидратир. диоксид ТiO2·nН2О
[гидроксид Ti(IV), оксо-гидрат Ti, оксогидроксид Ti] в зависимости от условий
получения может содержать переменные кол-ва связанных с Ti групп ОН, структурную
воду, кислотные остатки и адсорбир. катионы. Полученный на холоду свежеосажденный
ТiO2·nН2О хорошо раств. в разб. минер. и сильных
орг. к-тах, но почти не раств. в р-рах щелочей. Легко пептизируется с образованием
устойчивых коллоидных р-ров. При высушивании на воздухе образует объемистый
белый порошок плота. 2,6 г/см3, приближающийся цо составу к ф-ле
ТiO2·2Н2О (ортотитановая к-та). При натр. и длит. сушке
в вакууме постепенно обезвоживается, приближаясь по составу к ф-ле TiO2
· Н2О (метатитановая к-та). Осадки такого состава получаются при
осаждении из горячих р-ров, при взаимод. металлич. Ti с HNO3 и т.п.
Их плотн. ~ 3,2 г/см3 и выше. Они практически не раств. в разб. к-тах,
не способны пептизироваться. При старении осадки TiО2·nH2О
постепенно превращ. в безводный диоксид, удерживающий в связанном состоянии
адсорбир. катионы и анионы. Старение ускоряется кипячением суспензии с водой.
Структура образующегося при старении TiO2 определяется условиями
осаждения. При осаждении аммиаком из солянокислых р-ров при рН < 2 получаются
образцы со структурой рутила, при рН 2-5-со структурой анатаза, из щелочной
среды-рентгеноаморф-ные. Из сульфатных р-ров продукты со структурой рутила не
образуются. Получают TiО2·nH2О
гидролитич. осаждением из сульфатных р-ров или гидролизом TiCl4;
промежут. продукт при получении ТiO2, ионообменный материал. Лит.: Хазин Л. Г.,
Двуокись титана, 2 изд., Л., 1970; Производство тетра-хлорида и двуокиси титана,
L.-А., 1974; Гидратированный оксиды элементов IV и V групп, М., 1986.
П. И. Федоров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТИТАНА ОКСИДЫ
будет выглядеть так: Что такое ТИТАНА ОКСИДЫ
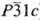 )
и Ti2O
(~25-33,4 ат.% О; а = 0,29593 нм, с = 0,48454 нм, пространств.
группа
)
и Ti2O
(~25-33,4 ат.% О; а = 0,29593 нм, с = 0,48454 нм, пространств.
группа 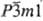 ). Промежут.
оксид Тi3О2-фаза с
гексагон. решеткой (а = 0,49915, с = 0,28794 нм, пространств.
группа Р6/mmm).
). Промежут.
оксид Тi3О2-фаза с
гексагон. решеткой (а = 0,49915, с = 0,28794 нм, пространств.
группа Р6/mmm).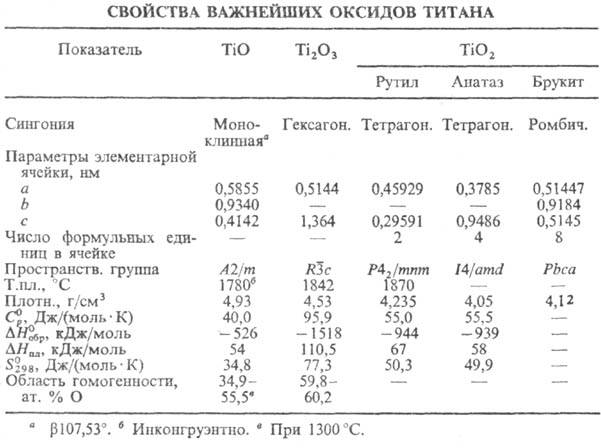
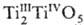 ,-голубые
или голубовато-черные
кристаллы моноклинной сингонии (а = 0,9757 нм, b = = 0,3802 нм,
с = 0,9452 нм, b = 93,11°, пространств. группа С2/m);
при 175°С превращ. в др. моноклинную модификацию; плотн. 4,29 г/см3;
,-голубые
или голубовато-черные
кристаллы моноклинной сингонии (а = 0,9757 нм, b = = 0,3802 нм,
с = 0,9452 нм, b = 93,11°, пространств. группа С2/m);
при 175°С превращ. в др. моноклинную модификацию; плотн. 4,29 г/см3;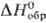 — 2460 кДж/моль; испаряется конгруэнтно с диссоциацией на TiO и ТiO2.
— 2460 кДж/моль; испаряется конгруэнтно с диссоциацией на TiO и ТiO2.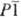 или
или
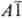 ).
).