Химическая энциклопедия
"ТИТАН"
Главная - Химическая энциклопедия - буква Т - ТИТАН
ТИТАН
(Titanium)
Ti, хим. элемент IV гр. периодич. системы, ат.н. 22, ат. м. 47,88. В природе
пять стабильных изотопов: 46Ti (7,95%), 47Ti (7,75%),
48Ti (73,45%), 49Ti (5,51%), 50Ti (5,34%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 5,6·10-28м2.
Конфигурация внеш. электронных оболочек атома 3d24s2;
степени окисления + 4 (наиб. характерна), +3 и +2; энергия ионизации при последоват.
переходе от Ti0 к Ti4+ равна соотв. 6,82, 13,58,
27,47, 43,24 эВ; сродство к электрону 0,39 эВ; электроотрицательность по Полингу
1,5; атомный радиус 0,149 нм, ковалентный радиус 0,132 нм, ионные радиусы, нм
(в скобках указаны координац. числа) Ti4+ 0,056 (4), 0,065 (5), 0,0745
(6), 0,088 (8), Ti3+ 0,081 (6), Ti2+ 0,100 (6). Содержание Т. в земной
коре 0,57% по массе. По распространенности в природе занимает 10-е место; в
своб. виде не встречается. Важнейшие минералы (известно св. 100): рутил ТiO2
(более редкие кристаллич. модификации - анатаз и брукит), ильменит FeTiO3,
титаномагнетит FeTiO3 + + Fe3O4, перовскит
СаТiO3 и титанит (сфен) CaTiOSiO4. Руды Т., имеющие пром.
значение, разделяются на две осн. группы: коренные - ильменит-титано-магнетитовые;
россыпные-рутил-ильменит-цирконовые. Крупные коренные месторождения ильменита
и титаномагнетитов находятся в Канаде, США, Норвегии, Швеции, ЮАР, Египте, Индии,
Австралии, СНГ. Общие запасы коренных месторождений оценивают в 600 млн. т по
содержанию Т. Россыпные руды имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии. Свойства. Т.-серебристо-белый
легкий металл; существует в двух кристаллич. модификациях: a-Ti с гексагон.
шютноупакованной решеткой, а = 0,2951 нм, с = 0,4697 нм, 2 = 2,
пространств. группа С6ттс; b-Ti с кубич. объемно-центрир.
решеткой, а = 0,3269 нм, z = 2, пространств. группа Iт3т;
т-ра перехода a Стандартный электродный
потенциал Ti0/Ti3+ -1,63 В, Ti3+/Ti4+
—0,20 В. На воздухе Т. покрывается защитной оксидонитридной пленкой, обусловливающей
его высокую коррозионную стойкость к воздуху (до 500 °С), морской воде,
разб. р-рам H2SO4, HCl и щелочей, р-рам хлоридов и влажному
Сl2. В HNО3 T. пассивируется. Реагирует
с конц. соляной и серной к-тами при 25 °С, с горячими трихлор- и трифторуксусными
к-тами, горячими конц. фосфорной, щавелевой и муравьиной к-тами. Фтористоводородная
к-та с Т. независимо от концентрации реагирует при 25 °С, присутствие фторид-ионов
способствует растворению Т. и в др. к-тах из-за образования комплексного аниона
[TiF6]2-. В конц. р-рах щелочей порошок Т. раств. с выделением
Н2 и образованием солей ортотитановой к-ты ТiO2·2Н2О. При 1200°С компактный
Т. загорается на воздухе и в атмосфере N2. Стружка и порошок Т. парофорны.
В системе Ti-O установлено существование фаз ТiOx с областью
гомогенности x = 0,60-1,26, Ti2O3 (Ti2O2x,
x = 1,42-1,57), ТiO2 (ТiOx, x = 1,98-2,0;
см. Титана оксиды
). Гидроксид ТЮ(ОН)2 · хН2О
м.б. осажден NH3 и др. основаниями из р-ров солей Т., разложением
титанатов щелочных металлов разб. к-тами и гидролизом р-ров, содержащих Ti(FV). В соед. с галогенами Т.
проявляет степени окисления +4, + 3, +2 и очень редко +1, связь Ti—X преим.
ковалентная, ее полярность возрастает с увеличением радиуса галогена (см. Титана галогениды
). Соед. Ti с др. неметаллами
чаще всего относятся к соед. внедрения атомов неметаллов малых размеров (Н,
В, С, N, О, Si) в междоузлия решетки Ti. В системе Ti - H обнаружен ряд
твердых р-ров и гидрид переменного состава TiH1+x (x
= 1,0-1,98)-серое аморфное в-во; получают восстановлением ТiO2 гидридом
Са, применяют для получения очень чистого Н2. При натр. смеси ТiO2
с сажей при 1900-2000 °С в атмосфере Н2 образуется титана карбид
TiC, при взаимод. порошка Т. с N2 при 800-1000 °С
или TiCl4 с NH3 при нагр. получают титана нитрид
TiN.
Спеканием порошков Т. и Si в вакууме или алюмотермич. восстановлением смеси
ТiO2 с SiO2 получены силициды: Ti5Si13,
TiSi и TiSi2. Спеканием порошков Ti и В в атмосфере Аг при 2000 °С
или в вакууме при 1800—2000°С выделены бориды: Ti2B, TiB2
и TiB (изоморфен TiC, TiN и TiO, образует с ними непрерывные твердые р-ры).
Для Т. известны сульфиды, селениды и теллуриды. Т. образует соли с кислородсодержащими
к-тами -титана сульфаты
, нитраты, фосфаты и др. С оксидами элементов
I, II, III гр. периодич. системы ТiO2 дает многочисл. титанаты, многие
из к-рых обладают сегнето-электрич. св-вами и высокими диэлектрич. постоянными.
См. также Титанорганические соединения
. Т. образует сплавы со всеми
металлами, кроме щел.-зем. и щелочных. Большинство металлов при растворении
в Т. понижает т-ру перехода a Получение. Ильменитовые
концентраты, содержащие 40-62% ТiO2 и 40-48% FeO + Fe2O3,
чаще всего подвергают либо сернокислотной, либо пирометаллургич. переработке.
В первом случае концентраты разлагают H2SO4, выщелачивают
водой и гидролизуют образовавшиеся окси-сульфаты Т.; получают гидроксид Ti,
к-рый прокаливают до ТiO2. Побочный продукт - FeSO4 ·
7Н2О. Пирометаллургич. переработка
состоит в восстановит. плавке ильменитовых концентратов с коксом или антрацитом
и послед. хлорировании титанового шлака (содержит 80-85%
ТiO2); затем проводят очистку TiCl4, его восстановление
с получением титановой губки, переплавку губки и рафинирование металла. Алюмотермич.
восстановлением ильменитовых концентратов получают ферротитан. Восстановит. плавку ильменитовых
концентратов ведут в электродуговых печах при 1600-1700 °С, загружая в печи
брикетированную или порошкообразную шихту и получая два продукта-чугун и титановый
шлак. Извлечение Т. в шлак составляет 96,0-98,5%, Fe в чугун-96-97%, расход
электроэнергии на 1 т шлака 1900-2100 кВт·ч. Состав шлака: 82-87% ТiO2,2,7-6,5%
FeO, 2,8-5,6% SiO2, 2-6% А12О3, 2-6% MgO, а
также СаО, МnО, Сr2О3 и др. Хлорирование ТiO2,
титановых шлаков и др. титансодержащих продуктов проводят ок. 900—1000 °С
в шахтных печах, реакторах с солевым расплавом или реакторах кипящего слоя.
К исходному продукту добавляют кокс, к-рый связывает кислород оксидов в смесь
СО и СО2 и влияет на равновесие процесса. Перед хлорированием в шахтных
печах титановые концентраты или шлаки смешивают с нефтяным коксом (20-25% в
шихте) и связующими, брикетируют и прокаливают брикеты при 800-850 °С. Хлорирование в расплаве,
содержащем КС1, NaCl, СаСl2, MgCl2 и небольшие кол-ва
др. хлоридов, не требует брикетирования порошкообразной шихты; уд. производительность
реакторов выше, чем шахтных печей. Реакц. газы из хлораторов
направляют на очистку в солевых фильтрах (примеси FeCl3, AlCl3,
нек-рых оксихлоридов образуют с NaCl и КС1 легкоплавкие хлорометаллаты), а затем
на конденсацию TiCl4. Очищают TiCl4 ректификацией (от
нек-рых примесей-их селективным восстановлением). Восстанавливают TiCl4
обычно магниетермически (процесс Кролля). Таким путем получают ок. 80% всего
Т. Применяют спец. герметичные реторты, рассчитанные на одноврем. получение
от 1 до 10 т Ti, с суточной производительностью до 140 т. TiCl4 подают
в реторту непрерывно или периодически, одновременно сливая накопившийся рас-плавл.
MgCl2. По завершении процесса реторту охлаждают, извлекают и очищают
полученный пористый Т.-титановую губку (напр., длит. отгонкой избытка Mg и оставшегося
MgCl2 в вакууме при 900 °С; см. также Металлотермия
). Применяют также натриетермич.
восстановление TiCl4 с послед. отмывкой губки от NaCl слабым р-ром
НС1. Получаемый при этом порошкообразный Т. переплавляют. Описано восстановление
TiO2 с помощью Са, а также СаН2. Рафинируют Т. электролитически
или иодидным способом (с промежут. образованием TiI4), для получения
слитков используют дуговую, электроннолучевую или плазменную переплавку. Масса
слитков Т. достигает 4-9 т. Сульфатная и пирометаллургич.
схемы могут совмещаться. Так, титановые шлаки после восстановит. плавки ильменитовых
концентратов м.б. подвергнуты сульфатизации. Разрабатываются процессы
непосредств. хлорирования ильменитовых концентратов, фторидной переработки титанового
сырья, получения искусств. рутила из ильменитовых концентратов, электролитич.
произ-ва Т. из TiCl4 в расплаве хлоридов, плазмохим. восстановления
TiCl4 и др. Определение. Щелочи, NH3
и (NH4)2S на холоду осаждают из р-ров Ti(IV) в виде Ti(OH)4.
Титансодержащие анализируемые материалы переводят в р-р действием фтористоводородной
к-ты или H2SO4 с добавкой HF, сплавлением с NaOH
или с его смесью с Na2CO3 или Na2O2,
а также с Na2S2O7. Отделяют Т. от др. элементов
действием H2S в виннокислой среде, купферона, салициловой к-ты, NaOH.
Наиб. важные методы определения Т.-колориметрический, основанный на р-ции с
Н2О2, и объемный, заключающийся в восстановлении Т. цинком
и послед. титровании КМnО4. Гравиметрич. методы (весовая форма -
прокаленный ТiO2) основан на осаждении щелочами, сульфидами щелочных
металлов, купфероном и др., их используют для анализа простых продуктов. Применение. Т. используют
в осн. для получения легких прочных сплавов с Аl, V, Мо, Мn, Сr и др. (см. Титана
сплавы
).
В странах Запада и в Японии наиб. распространение получил сплав Ti-Al-V,
на произ-во к-рого идет до 50% Т. Чистый Т. в виде кованы деталей, ленты, проволоки
и др. применяют в электровакуумной технике для изготовления анодов, сеток и
др. деталей, в виде порошка-в качестве газопоглотителя (геттера). С целью защиты
от коррозии Т. покрывают пов-сти стальных изделий. Ферротитан (содержит 18-25%
Ti) применяют для раскисления стали и удаления растворенных в ней кислорода,
азота и серы. Присадки Т. вводят в разл. (марганцовистые, хромистые, хро-момолибденовые,
хромоникелевые и др.) спец. стали, медные и алюминиевые сплавы. В 80-х гг. в развитых странах
ок. 60-65% Т. использовали в ракето- и самолетостроении, 15% в хим. машиностроении,
10% в энергетике, 8% в кораблестроении и для опреснителей морской воды. Гидрид Т. служит лаб. источником
чистого Н2; K2TiF6 используют при переплавке
А1 и его сплавов для получения слитков с тонкой структурой зерен и лучшими мех.
св-вами, а также для получения лигатур Al-Ti и Al-Ti-B. Слоистый дисульфид TiS2-перспективный
материал для катодов хим. источников тока с Li-анодом, борид TiB2-материал
для плавки Be и др. металлов, электродов для плавки А1. Мировое произ-во Т. (без
СНГ) 30 тыс. т/год. Т. открыл в 1790 У. Грегор
в виде ТiO2. Лит.: Горощенко
Я.Г., Химия титана, ч. 1-2, К., 1970-72; Лучин-ский Г. П., Химия титана,
М., 1971; Сергеев В. В., Безукладников А. Б., Мальшин В.М., Металлургия титана,
М., 1979; Титан. Свойства, сырьевая база, физико-химические основы и способы
получения, М., 1983; Clark R. J. H., в кн.: Bradley D.C., Thornton P.,
Zirconium and hafnium, N.Y.-[a.o.], 1975; "Atomic Energy Review",
1983, spec, issue, № 9; Titanium: science and technology. Proc. 5th Int Conf.,
Munich, sept 10-14, 1984, v. 1-5, 1985. Н.Э. Раков. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТИТАН
будет выглядеть так: Что такое ТИТАН
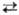 b
883 °С, DH перехода 3,8 кДж/моль. Т. пл. 1671°С, т. кил.
3260 °С; плотн. a-Ti и b-Ti равна соотв. 4,505 (20 °С) и 4,32
(900 °С) г/см3;
b
883 °С, DH перехода 3,8 кДж/моль. Т. пл. 1671°С, т. кил.
3260 °С; плотн. a-Ti и b-Ti равна соотв. 4,505 (20 °С) и 4,32
(900 °С) г/см3; 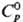 25,1 Дж/(моль · К);
25,1 Дж/(моль · К); 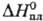 14,6 кДж/моль,
14,6 кДж/моль,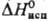 397 кДж/моль;
397 кДж/моль; 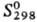 30,7 Дж/(моль · К); т-ра перехода в сверхпроводящее
состояние 0,42 К; ур-ние температурной зависимости давления пара: lgp(кПа)
= 5,7904-24644/T-0,0002277;
температурный коэф. линейного расширения 8,2·10-6 К-1
(20-300°С); теплопроводность 21,9 Вт/(м·К) (300 К); r 0,42 мкОм·м (20
°С), 1,80 мкОм·м (800 °С); парамагнетик, удлмагн. восприимчивость +3,2·10-6
(20 °С); постоянная Холла a-Ti +1,82·10-13. Т. обладает
высокими мех. характеристиками, сравнительно слабо зависящими от т-ры и сильно-от
чистоты и способов предварит. обработки. Для высокочистого, отожженного в вакууме
Т. араст 240-260 МПа, предел текучести 140-170 МПа, относит. удлинение
55-70%, модуль упругости 96-106 ГПа, твердость по Бринеллю 175 МПа.
30,7 Дж/(моль · К); т-ра перехода в сверхпроводящее
состояние 0,42 К; ур-ние температурной зависимости давления пара: lgp(кПа)
= 5,7904-24644/T-0,0002277;
температурный коэф. линейного расширения 8,2·10-6 К-1
(20-300°С); теплопроводность 21,9 Вт/(м·К) (300 К); r 0,42 мкОм·м (20
°С), 1,80 мкОм·м (800 °С); парамагнетик, удлмагн. восприимчивость +3,2·10-6
(20 °С); постоянная Холла a-Ti +1,82·10-13. Т. обладает
высокими мех. характеристиками, сравнительно слабо зависящими от т-ры и сильно-от
чистоты и способов предварит. обработки. Для высокочистого, отожженного в вакууме
Т. араст 240-260 МПа, предел текучести 140-170 МПа, относит. удлинение
55-70%, модуль упругости 96-106 ГПа, твердость по Бринеллю 175 МПа. b
и стабилизирует b-фазу.
b
и стабилизирует b-фазу.