Химическая энциклопедия
"ТИОМОЧЕВИНА"
Главная - Химическая энциклопедия - буква Т - ТИОМОЧЕВИНА
ТИОМОЧЕВИНА
(диамид
тиоугольной к-ты, тиокарба-мид) (NH2)2CS, мол. м. 76,12;
бесцв. кристаллы горького вкуса; т. пл. 182°С (при быстром нагревании; при
медленном нагревании не имеет четкой т-ры плавления); плотн. 1,399-1,405 г/см3;
длины связей (нм) 0,171 (C=S), 0,133 (С—N), угол NCS 122,2°. Р-римость
в воде (% по массе): 4,7 (0,2 °С), 9,3 (12,3 °С), 13,2 (22,7 °С),
40,5 (60,2 °С), 66,7 (97 °С); р-римость (г в 100 г орг. р-рителя): в
метаноле -11,9 (25 °С), этаноле-4,0 (25°С), пиридине-12,5 (20°С),
50%-ный водный р-р пиридина 41,2 (24 °С); не раств. в диэтиловом эфире,
бензоле, ССl4. С углеводородами Т. образует,
подобно мочевине, клат-раты, способные удерживать неск. больших молекул; при
этом линейные углеводороды удерживаются слабо, наиб. устойчивы комплексы с объемными
молекулами, напр. с n-ди(трет
-бутил)бензолом, 2,2,4-триметилпентаном,
скваленом, адамантаном
и др. (мочевина с указанными соед. клатратов не образует). При длит. нагревании при
130°С Т. превращ. в NH4SCN, выше 200 °С разлагается с выделением
NH2CN, H2S, NH3, CS2 и др. продуктов. Структура молекулы Т. может
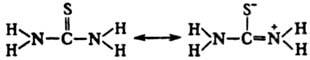
быть представлена резонансными тиоамидо- и тиоимидоформами с преобладающим вкладом
последней, что обусловливает хим. св-ва Т.: В хим. р-циях Т. в качестве
нуклеоф. центра выступает атом S, а не атом N (как в мочевине). Т. образует
соли с галогенами, минер. и орг. к-тами, а также нек-рыми основаниями, напр.: С солями ряда металлов
(Сr, Zn, Cd, Hg, Pb, Ni, Со) дает комплексные соединения. Легко реагирует с
алкилгалогени-дами, диалкилсульфатами и др. алкилирующими агентами с образованием
S-алкилпроизводных изотиомочевины (S-алкилизотиурониевых солей). Последние малоустойчивы
и при попытке выделения распадаются до тиолов: Аналогично Т. взаимод.
в присут. НС1 с нек-рыми спиртами (напр., с бензиловым, фурфуриловым). S-Алкилпроиз-водные
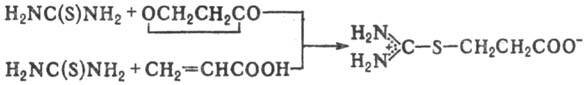
образуются также при действии на Т. b-лактонов или a,b-ненасыщ.
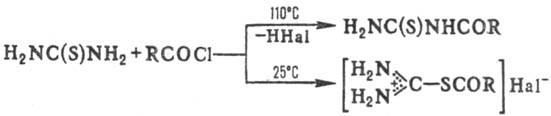
к-т, напр.: Взаимодействие Т. с ацилгалогенидами
или ангидридами карбоновых к-т в зависимости от т-ры р-ции приводит к N- или
S-ацилпроизводным: S-Арилирование Т. осуществляют
с помощью активир. арилгалогенидов или арендиазониевых солей. При взаимодействии Т. с
альдегидами или кетона-ми образуются гидроксиалкилтиомочевины, к-рые при отщеплении
воды м. б. превращены в N-тиокарбамоилимины: Т. подвергается окислит.
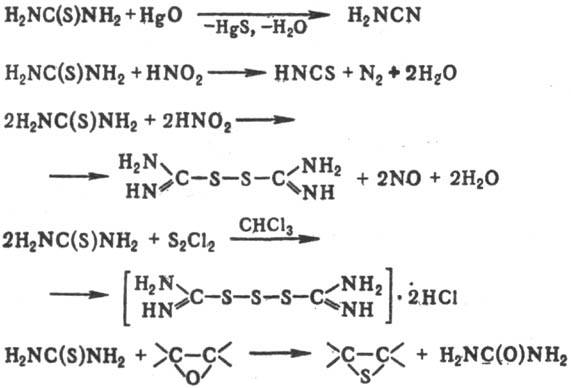
десульфуризации под действием Рb3О4 или HgO с образованием
цианамида; с нитритами металлов в присут. к-т
в зависимости от рН среды образует тиоциановую к-ту или формамидиндисульфид,
при обработке S2Cl2 в СНСl3 дает дигидрохлорид
формамидинтри-сульфида; с эпоксидами образует тиираны: При нагр. в присут. к-т
или оснований Т. гидролизуется с образованием NH3, H2S
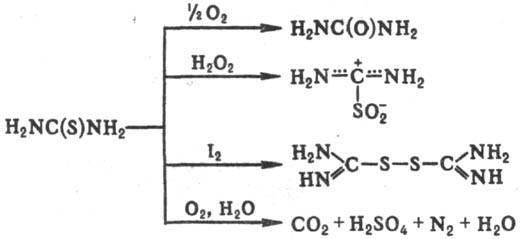
и СО2. Под действием окислителей в зависимости от их природы и условий
образует мочевину, формамидинсульфиновую к-ту (диоксид Т.) или формамидиндисульфид,
более глубокое окисление приводит к СO2, H2SO4
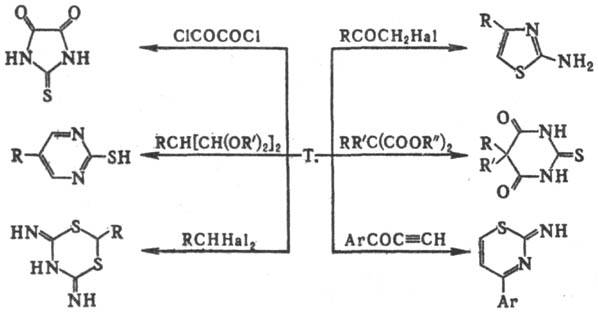
и N2: Р-ции Т. с бифункцион.
соединениями используют для синтеза разл. гетероциклич. систем, напр.: Т. получают изомеризацией
тиоцианата аммония при нагр. выше 150°С: NH4SCN Ca(CN)2 + (NH4)2S
+ 2Н2O : H2NC(S)NH2 + Са(ОН)2 + 2NH3 CS2 + 2NH3 :
H2NC(S)NH2 + H2S Для определения Т. используют
титрование р-рами окислителей (хлорамины и др.) в присут. KI. В своб. виде Т. содержится
в нек-рых растениях. Т. применяют в синтезе
тиолов, красителей, синтетич. смол, в произ-ве лек. препаратов, для разделения
парафинов, в качестве реагента для фотометрич. определения Bi, Os, Re, Ru; обладает
фунгшщдным действием. Т.-малотоксична, ЛД50
8 г/кг (мыши, перорально), ПДК в атмосфере 0,01 мг/м . При неоднократном воздействии
на организм угнетает ф-ции щитовидной железы, органов кроветворения, снижает
активность ряда ферментов тканевого дыхания. Лит.: Физер Л.,
Физер М., Реагенты для органического синтеза, пер. . с англ., т. 3, М., 1970,
с. 324-27; Gmclin Handbuch der anorganischen Chenue, 8 Aufl., Tl D6, В., 1978,
S. 51-131. И.И. Крылов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТИОМОЧЕВИНА
будет выглядеть так: Что такое ТИОМОЧЕВИНА
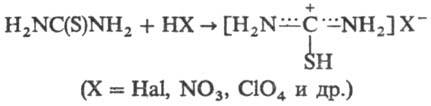
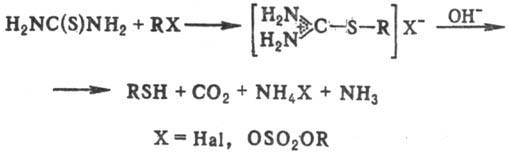
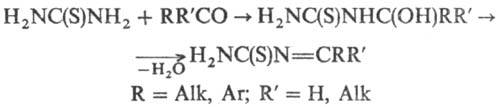
 H2NC(S)NH2.
Равновесная смесь NH4SCN и Т. содержит 28,1% Т. (140 °С), 26,7%
Т. (156 °С), 21,8% Т. (180 °С); оптим. т-ра р-ции 170 °С. Т. получают
также взаимод. цианамида кальция с H2S или с неорг. сульфидами в
водных р-рах либо р-цией CS2 с NH3 или (NH4)2CO3
при 160 °С:
H2NC(S)NH2.
Равновесная смесь NH4SCN и Т. содержит 28,1% Т. (140 °С), 26,7%
Т. (156 °С), 21,8% Т. (180 °С); оптим. т-ра р-ции 170 °С. Т. получают
также взаимод. цианамида кальция с H2S или с неорг. сульфидами в
водных р-рах либо р-цией CS2 с NH3 или (NH4)2CO3
при 160 °С: