Химическая энциклопедия
"ТЕНЗИМЕТРИЯ"
Главная - Химическая энциклопедия - буква Т - ТЕНЗИМЕТРИЯ
ТЕНЗИМЕТРИЯ
(от лат.
tensus - напряженный, натянутый и греч. metreo- измеряю), совокупность методов
измерения давления пара. Существуют прямые и косвенные тензимет-рич. методы.
Первые основаны на использовании манометров
разл. конструкций, вторые-на
исследовании к.-л. св-ва в-ва, к-рое связано с давлением пара. Измеряемыми параметрами
в косвенных методах м. б. масса, скорость испарения, оптич. плотность и др.;
давление рассчитывают по известным ур-ниям или определяют с помощью предварительно
полученных градуировочных кривых. В зависимости от условий
парообразования методы Т. можно разделить на статические, динамические и кинетические
(см. табл.). К статическим относят, в частности, методы исследования газофазных
и гетерог. равновесии, в к-рых процессы протекают в замкнутом, предварительно
вакуумир. объеме (в реакторе). Благодаря этому систему всегда можно привести
в состояние термодинамич. равновесия независимо от кинетич. особенностей процессов.
Давление пара измеряют манометром, чаще всего U-образной формы, соединенным
непосредственно с реактором, нагретым до определенной т-ры. Манометрич. жидкостью
может служить ртуть (если манометр находится при комнатной т-ре), а также др.
в-ва (напр., расплавленные металлы, соли, оксид бора) в т. наз. изотенископах.
Исследования хим. р-ций можно проводить с помощью спирального или мембранного
манометра. Тогда давление пара определяют либо по градуировочной кривой, связывающей
величину деформации мембраны с давлением пара, либо компенсац. методом. 
Наиб. универсальный прямой
статич. метод-измерение общего давления пара в замкнутом объеме с помощью мембранного
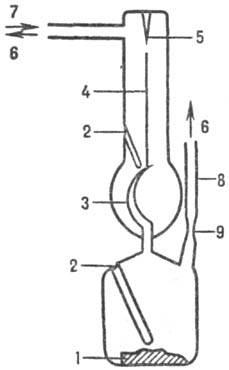
манометра Бурдона, используемого как нуль-прибор в компенсац. схеме (см. рис.).
Датчиком давления служит чувствит. деформируемая мембрана 3, разделяющая реакц.
и компенсац. объемы (на рис. изображена мембрана серповидной формы, обеспечивающая
высокую чувствительность прибора). Исследуемое в-во 1 через трубку 8 загружают
в реакц. камеру известного объема, откачивают воздух, перепаивают под вакуумом
в точке 9, помещают в печь и нагревают до нужной т-ры, измеряемой в неск. точках.
Реакц. объем находится в изотермич. условиях. В-во полностью (ненасыщ, пар)
или частично (насыщ. пар) испаряется. Создаваемое в камере давление деформирует
мембрану 3, вследствие чего припаянный к ней шток 4 отклоняется. Если в компенсац.
камеру через трубку 7 ввести инертный газ под давлением, равным давлению пара
исследуемого в-ва, то шток 4 возвратится в исходное положение, фиксируемое по
указателю 5. Давление компенсирующего газа измеряют независимо, обычно ртутным
манометром. Таким способом можно определять
давление насыщ. и нена-сыщ. паров в широком интервале т-р (до 900 °С в кварцевой
аппаратуре).
Схема манометра Бурдона:
1-исследуемое в-во; 2-"карманы" для термопар; 3 - серповидная мембрана;
4-шток; 5-указатель нулевого положения; 6-к вакуумной системе; 7-напуск компенсирующего
газа; 8-трубка для загрузки образца; 9-место перепайки под вакуумом. К статич. методам относят
также оптический, весовой и метод точки росы. Оптич. метод основан на законе
Бугера - Ламберта - Бера (см. Абсорбционная спектроскопия
), описывающем
зависимость интенсивности монохро-матич. излучения, прошедшего через кювету
с исследуемым в-вом (в парообразном состоянии), от концентрации последнего,
к-рая связана с давлением пара. Весовым методом давление пара p определяют
по массе т испарившегося в-ва: p = mRT/MV, где М-мол.
масса изучаемого в-ва, V- объем пара, R-универсальная газовая
постоянная, Т-абс. т-ра. Метод точки росы основан на фиксации т-ры начала
конденсации летучего компонента смеси на холодной пов-сти реактора. Давление
пара при этом вычисляют из справочных данных по температурной зависимости давления
насыщ. пара чистого летучего компонента. В динамических методах
испарение конденсир. фазы происходит в открытой системе, через к-рую пропускают
инертный или реагирующий с исследуемым в-вом газ. В методе потока давление пара
рассчитывают, как и в весовом методе, по кол-ву испарившегося (или прореагировавшего)
в-ва. В методе точек кипения измеряют скорость испарения в-ва в зависимости
от т-ры при p —
const (изобарич. вариант) или от давления при Т= const
(изотермич. вариант). Поскольку в момент начала кипения, когда давление насыщ.
пара в-ва становится равным давлению в окружающей среде, скорость испарения
резко возрастает, по полученным кривым можно определить давление насыщ. пара
при т-ре кипения. Кинетические методы основаны
на исследовании испарения в-ва в вакууме. В методе Ленгмюра испарение происходит
с открытой пов-сти. Давление насыщ. пара вычисляют по ур-нию: p = m Интервалы значений давления
пара, измеряемые разл. методами, приведены в таблице. Методы Т. применяют гл.
обр. при изучении хим. и фазовых равновесий. В первом случае исследуют хим.
р-ции между индивидуальными в-вами в газообразном состоянии и
в гетерог. системах. Из температурной зависимости давления насыщ. пара, используя
ур-ние Клапейрона-Клаузиуса и ряд допущений, можно вычислить для индивидуальных
в-в энтальпии сублимации (для равновесия твердое тело-пар) и испарения (для
равновесия жидкость-пар). Разность между ними равна энтальпии плавления. В простых
системах, содержащих не более трех мол. форм в парах, с помощью второго и третьего
законов термодинамики по данным-тензиметрич. измерений вычисляют изменения энтальпии
DH0 и энтропии DS0 хим. р-ции.
Применение методов термодинамич. моделирования для анализа тензиметрич. результатов
позволяет исследовать хим. равновесия с неск. параллельными р-циями. Исследования фазовых равновесий
методами Т. ранее заключались в определении парциальных давлений р-рителя и
растворенного в-ва над идеальными р-рами (с использованием законов Рауля и Генри);
в измерении мол. массы растворенного в-ва по повышению т-ры кипения р-ра (эбу-лиоскопия);
в исследовании равновесий жидкость-пар. Позднее с помощью Т. стали изучать равновесия
в фазовом пространстве давление - т-ра - состав (р-Т-X-диаграммы) с целью
определения областей существования фаз и функ-цион. зависимостей между составами
фаз, т-рой и давлением пара. На этом основаны тензиметрич. исследования отклонения
от стехиометрии в кристаллах (тензиметрич. сканирование пов-сти солидуса), что
особенно важно для в-в (полупроводников и др. неорг. материалов), физ. св-ва
к-рых резко меняются в зависимости от состава в узкой (менее 1 ат. %) области
гомогенности. Лит.: Несмеянов
А. Н., Давление пара химических элементов, М., 1961; Суворов А. В., Термодинамическая
химия парообразного состояния, Л., 1970. Я. X. Гринберг. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТЕНЗИМЕТРИЯ
будет выглядеть так: Что такое ТЕНЗИМЕТРИЯ
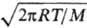 /(Sтa),
где m-масса в-ва с мол. массой М, испарившегося за время т с пов-сти
площадью S, a-т. наз. коэф. испарения, p = 3,14. В методе Кнудсена
измеряют скорость эффузии, т. е. истечения в-ва из камеры в вакуум через маленькое
отверстие. Экспериментально измеренное давление пара pэ связано
с массой испарившегося в-ва ур-нием: рэ=m.
/(Sтa),
где m-масса в-ва с мол. массой М, испарившегося за время т с пов-сти
площадью S, a-т. наз. коэф. испарения, p = 3,14. В методе Кнудсена
измеряют скорость эффузии, т. е. истечения в-ва из камеры в вакуум через маленькое
отверстие. Экспериментально измеренное давление пара pэ связано
с массой испарившегося в-ва ур-нием: рэ=m.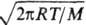 /К,
где К-коэф., характеризующий геом. размеры отверстия. Равновесное
давление пара рр рассчитывают по ур-нию: p = рэ/s,
где s = (1 + aK/Sкa)-1,
а-площадь отверстия, Sк- площадь внутр. сечения
камеры. В торсионном методе кроме скорости эффузии определяют угол закручивания
камеры, подвешенной на нити, под действием струи пара, вытекающей из двух противоположно
направленных отверстий.
/К,
где К-коэф., характеризующий геом. размеры отверстия. Равновесное
давление пара рр рассчитывают по ур-нию: p = рэ/s,
где s = (1 + aK/Sкa)-1,
а-площадь отверстия, Sк- площадь внутр. сечения
камеры. В торсионном методе кроме скорости эффузии определяют угол закручивания
камеры, подвешенной на нити, под действием струи пара, вытекающей из двух противоположно
направленных отверстий.