Химическая энциклопедия
"ТЕЛЛУРИДЫ"
Главная - Химическая энциклопедия - буква Т - ТЕЛЛУРИДЫ
ТЕЛЛУРИДЫ
, соединения
Те с менее элсктроотрицат. элементами, гл. обр. с металлами. По строению, составу
и св-вам Т. являются аналогами др. халькогенидов - сульфидов и селенидов. В
Т. s-элементов хим. связь ионно-ко-валентная, ковалентная составляющая
хим. связи возрастает при переходе от Li к Cs и от Be к Ва. Щелочные металлы
образуют Т. типа М2Теn, где n = 1 — 4. Т.
состава М2Те являются солями теллуристоводородной к-ты Н2Те,
бесцв., кристаллизуются в решетке типа антифлюорита CaF2. Гигроскопичны,
при доступе воздуха разлагаются с выделением Те, раств. в воде, р-ры устойчивы
только в отсутствие
О2. Полителлуриды М2Теn-серо-черные
кристаллы с металлич. блеском; разлагаются в присут. О2 и влаги. Щел.-зем. металлы образуют
с Те соед. типа МТе. Это бесцв. кристаллы с кубич. решеткой типа NaCl, кроме
ВеТе с кубич. структурой типа сфалерита и MgTe со структурой типа вюрцита. На
воздухе окрашиваются в красноватый цвет, водой и к-тами разлагаются с выделением
Те. Т. p-элементов более
разнообразны по составу и характеризуются преим. ковалентным характером хим.
связи. Для элементов III гр. известны соед. АIIIТе, При переходе от Ga к Тl
устойчивость соед. АIIIТе и Т. германия, Sn, Pb состава
МТе кристаллизуются в структуре типа NaCl. Т. кремния (плавится инконгруэнтно)
имеет состав Si2Te3 (см. табл.); при нагр. в вакууме разлагается
с образованием твердого Si и газообразных SiTe и Те2. Кубич. модификация
Т. олова и Ge переходит в ромбоэдрическую соотв. при 15-70 К и 663-773 К в зависимости
от состава. 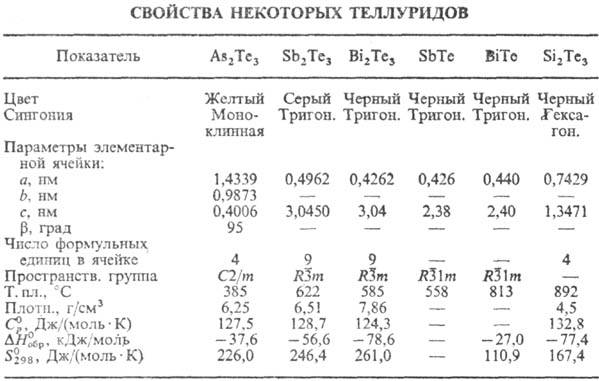
p-Элементы Va гр.
образуют Т. состава Структура Т. мышьяка построена
из блоков, состоящих из шести рядов атомов Т. и четырех рядов атомов As, связанных
между собой слабой связью типа ван-дер-ваальсовой. Структуры Т. сурьмы и Bi
слоистые и различаются между собой числом и порядком чередования пятислойных
пакетов из атомов металла и Те и двухслойных пакетов из атомов металла. Т. мышьяка,
Sb, Bi при нагр. в вакууме разлагаются с образованием газообразных М2,
Те2, МТе, М2Те2 . Т. d- и f-элементов
менее разнообразны по составу. Для большинства из них характерно образование
соед. типа МТе (структуры типа NiAs, NaCl) и UTe2 (структуры типа
CdI2, MoS2, FeS2 и т.д.). Для Т. цинка, Cd, Hg характерно
явление политипии и в зависимости от условий они кристаллизуются в кубич. структуре
типа сфалерита или гексагональной типа вюрци-та. Наим. число Т. характерно для
переходных металлов с относительно устойчивыми d5- и
d10-конфигурациями атомных оболочек. Напр., Сr, Мn и
Re образуют не более двух Т., a Ag, Аu, Zn, Cd, Hg-no одному (Ag2Te,
AuTe2, CdTe и т.д.). По мере увеличения содержания Те характер хим.
связи изменяется от
ионной и металлической к ковалентной, образуются слоистые псевдомолекулярные
структуры. Т. переходных металлов характеризуются значит. областями гомогенности.
При увеличении содержания Те в результате образования металлич. вакансий может
происходить непрерывный переход от структуры типа NiAs к структуре типа CdI2,
напр.: переходы TiTe-TiTe2, PdTe-PdTe2. Т. d- и f-элементов-тугоплавкие
соед.; напр., т. пл. для Т. РЗЭ достигает 1300-2000 °С. С повышением содержания
Те в Т. их устойчивость понижается. Во влажном воздухе Т. d-и f-элементов
постепенно разлагаются, в воде и к-тах-не-окислителях не раств., при нагревании
раств. в к-тах-окис-лителях. В атмосфере О2 окисляются с образованием
окси-теллуридов, напр. Получают Т. след. способами:
1) непосредств. сплавлением компонентов в вакуумир. контейнерах; 2) взаимод.
паров Те при нагр. с твердым или жидким металлом в инертной атмосфере или в
присут. Н2; 3) осаждением Т. теллуристым водородом или (NH4)2Te
из р-ров солей соответствующих металлов; 4) восстановлением теллуритов или теллуратов
водородом, NH3, N2H4; 5) электрохим. способом,
когда в качестве катода используют Те, а анода-металл, Т. к-рого нужно получить.
Монокристаллы Т. выращивают направленной кристаллизацией из расплава по методу
Чохральского, Бриджмена, зонной плавкой, осаждением из пара с помощью химических
транспортных р-ций, в частности с использованием металлоорганических соединений. Т. металлов I, II, IV,
V или VIII гр. периодич. системы элементов в природе встречаются в виде минералов:
гессита Ag2Te, колорадоита HgTe, сильванита AgAuTe4, алтаита
РbТе, теллуровисмутита Bi2Te3 и др. Большинство Т.-полупроводники.
С увеличением атомной массы катиона ширина запрещенной зоны уменьшается, напр.
от 3,0 эВ для ВеТе до 0,02 эВ для HgTe. Т. используют как материалы для термоэлектрич.
преобразователей в нагревающих и охлаждающих устройствах (Т. меди, Ag, Pb, Sn,
Ge, Sb, Bi и т. д.). Созданы термогенераторы, использующие солнечное тепло,
тепло ядерных реакторов с мощностью до десятков и сотен кВт. С помощью интеркалирования
ионов щелочных и щел.-зем. металлов в Т. со слоистой структурой (напр., Ga2Te3,
In2Te3) создают новые классы аккумуляторов солнечной и
злектрич. энергии. В акустооптике (см. Акустические материалы
) Т.
используют как лазерные материалы, материалы для фотоприемников (Т. цинка, Cd,
Hg, Pb и т.д.), а в акустоэлектронике-для создания усилителей, тензодатчиков
и т.д. Высокая чувствительность Т. к разл. излучениям (рентгеновскому, радиоактивному,
ИК и т.д.) обусловливает их применение как детекторов для измерения напряженности
магн. полей и т.д. Т. можно использовать для регистрации и хранения оптич. информации
в голографии и др. См. также Кадмия теллурий, Мышьяка халькогениды
, Олова халькогениды
, Ртути халькогениды
, Цинка халькогениды
и др. Лит.: Чижиков Д.
М., Счастливый В. П., Теллур и теллуриды, М., 1966; Полупроводниковые халькогениды
и сплавы на их основе, М., 1975; Абрикосов Н. X., Шелимова Л. Е., Полупроводниковые
материалы на основе соединений АIVВVI, М., 1975; Янаки
А. А., Теллуриды переходных металлов, М., 1990; Cordfunke E. H. P.,
Cluistra R., Van Milten-burg J. C, "J. Chem. Thermodyn.", 1985,
v. 17, p. 1079-89. В.П. Зломанов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТЕЛЛУРИДЫ
будет выглядеть так: Что такое ТЕЛЛУРИДЫ
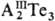 ,
Тl2Те.
,
Тl2Те.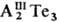 уменьшается-понижаются т-ры плавления и меняется характер плавления от конгруэнтного
(Т. галлия и In) до инконгруэнтного (Т. таллия). Тl2Те плавится конгруэнтно.
В области составов АIII-АIII Те наблюдается расслаивание
в жидкой фазе. Аl2Те3 во влажном воздухе быстро гидро-лизуется
с выделением Н2Те; теллуриды Ga, In и Tl на воздухе устойчивы.
В структуре
уменьшается-понижаются т-ры плавления и меняется характер плавления от конгруэнтного
(Т. галлия и In) до инконгруэнтного (Т. таллия). Тl2Те плавится конгруэнтно.
В области составов АIII-АIII Те наблюдается расслаивание
в жидкой фазе. Аl2Те3 во влажном воздухе быстро гидро-лизуется
с выделением Н2Те; теллуриды Ga, In и Tl на воздухе устойчивы.
В структуре 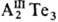 атомы
Те расположены в кубич.
или гексагон. упаковке, атомы металла занимают статистически только 2/3
позиций катионов. Остающиеся вакансии склонны к упорядочиванию и обусловливают
аномалии в физ. св-вах Т., напр. низкую теплопроводность, высокие коэф. диффузии
и р-римость примесей.
атомы
Те расположены в кубич.
или гексагон. упаковке, атомы металла занимают статистически только 2/3
позиций катионов. Остающиеся вакансии склонны к упорядочиванию и обусловливают
аномалии в физ. св-вах Т., напр. низкую теплопроводность, высокие коэф. диффузии
и р-римость примесей.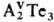 и AVTe.
и AVTe.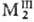 О2Те,
где M-Ln, а при нагревании дают оксиды металлов и ТеО2. При нагревании
в вакууме Т. d- и f-элементов разлагаются с образованием соответствующих
металлов.
О2Те,
где M-Ln, а при нагревании дают оксиды металлов и ТеО2. При нагревании
в вакууме Т. d- и f-элементов разлагаются с образованием соответствующих
металлов.