Химическая энциклопедия
"ТАЙРОН"
Главная - Химическая энциклопедия - буква Т - ТАЙРОН
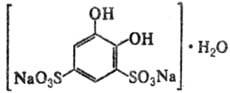
ТАЙРОН
(тирон, моногидрат
динатриевой соли 4,5-дигид-роксибензол-1,3-дисульфокислоты), мод. м. 332,22,
бесцв. кристаллы, плавится с разложением, раств. в воде, хуже - в этаноле, не
раств. в ацетоне и диэтиловом эфире. В воде рКа (RH2)
7,6; рКа (RH-) 12,5. Применяется как реагент для
фотометрич. определения Fe(III) при рН 9-10 и Ce(IV) при рН 8 с пределами обнаружения
0,1 и 1 мкг/мл при lмакс 480 и 500 нм
соотв., а также для титриметрич. определения германия. Т.-металлохромный индикатор
на Fe(III), Ge(IV), Ce(IV) и маскирующий агент в хим. анализе. ТАЛЛИЙ (от греч.
thallos-зеленая ветка; лат. Thallium) Tl, хим. элемент III гр. периодич. системы,
ат. н. 81, ат. м. 204.383. Природный Т.-смесь двух изотопов: 203Тl
(29,5%) и 205Тl (70,5%). Радиоактивные изотопы с мае. ч. от 206 до
210 и Т1/2 от 1,32 до 4,79 мин-члены природных радиоактивных
рядов. Поперечное сечение захвата тепловых нейтронов прир. смеси изотопов 3,4·10-28м2.
Конфигурация внеш. электронной оболочки атома 6s26р1;
степени окисления + 1 и + 3; энергии ионизации при переходе от Тl0
к Tl3+ 6,1080, 20,4284, 29,8 эВ; работа выхода электрона 3,70 эВ;
электроотрицательность по Полингу 1,8; атомный радиус 0,171 нм, ионные радиусы,
нм (в скобках указаны коор-динац. числа): Тl1+ 0,164 (6), 0,173 (8),
0,184 (12), Тl3+ 0,089 (4), 0,103 (6), 0,112 (8). Содержание Т. в земной
коре 3-10-4% по массе, в воде океанов 10-5 мг/л. Известно
30 таллиевых минералов, в т.ч. лорандйт TlAsS2, крукезит TlCu7Se4,
авиценнит Т12О3> вследствие большой редкости не имеющие
практич. значения. Т. рассеивается, являясь спутником К, в силикатах (слюды,
полевые шпаты содержат ~ 0,001% Т.). Накапливается в сульфидных минералах-галените,
сфалерите (до 0,1%), марказите, пирите (до 0,5%), иногда в халькопирите, киновари,
сульфидах As и Sb и т.п. Иногда встречается в прир. оксидах Мn и Fe. Свойства. Т.-белый металл
с голубоватым оттенком. Низкотемпературная модификация II имеет гексагон. решетку
типа Mg, а = 0,34566 нм, с = 0,55248 нм, 2 = 2, пространств. группа
Р62/ттс; высокотемпературная модификация I,
существующая выше 234 °С, имеет объемноцентрир. кубич. решетку типа a-Fe,
а — 0,3882 нм, z = 2, пространств. группа Iт3т (DH
перехода II
Стандартный электродный
потенциал —0,3363 В, относительно щелочных р-ров — 0,344 В. На воздухе Т. быстро
темнеет и покрывается черной коркой, содержащей Тl2О Вода, не содержащая
растворенного О2, на Т. не действует, в присут. О2 растворяет
его с образованием ТlOН. .Т. реагирует с галогенами при комнатной т-ре, при
натр.-с S, Se, Те, Р. С As сплавляется без образования соединений. С Н2,
N2, NH3, С, Si, В, сухим СО2 не взаимодействует.
Легко раств. в HNO3, неск. хуже-в H2SO4. Соляная
к-та на Т. действует слабо из-за образования пленки Т1С1. Со щелочами не реагирует.
С этанолом в присут. О2 образует этилат. Соед. Tl(I),
напоминающие по св-вам соед. К, Ag и Рb, наиб. устойчивы. Соед. Т1(III) термически
малоустойчивы, легко восстанавливаются и легко гидролизуются. Тl(I) окисляется
до Тl(III) при действии K2S2O7, KBrO3,
КМnО4, бромной воды и т.д. Тl(III) восстанавливается в р-рах до Тl(I)
действием SO2, H2S, Na2S2O3,
а также металлов-Zn, Fe и даже Си. Во мн. соединениях Т. присутствует одновременно
в двух степенях окисления, напр. Тl2Сl3-гекса-хлороталлат(III)
таллия(l). О св-вах соед. см. табл. 1 и 2. Оксид Тl(I) (гемиоксид)
Тl2О гигроскопичен; ур-ние температурной зависимости давления пара:
lgp (мм рт. ст.) = = 11,51 - 6612/T(453-588 К); при натр, на воздухе
окисляется; реагирует с водой с образованием ТЮН; получают окислением Т., разложением
ТlOН, Т12СО3. Гидроксид ТlOН-желтые кристаллы моноклинной
сингонии (а = = 2,120 нм, b = 0,6240 нм, с = 0,5950 нм, b
= 91,65°, z = 16); плавится инконгруэнтно при 130°С; плотн. 7,44
г/см3; Оксид Тl(III) (сесквиоксид)
Тl2О3 на воздухе уже при 500 °С начинает диссоциировать,
не раств. в воде и орг. р-рителях, раств. в разб. минеральных, а также в уксусной
к-тах; получают окислением солей Тl(I) в щелочной среде Н2O2
и др. методами. Производные Тl2О3-таллаты, напр. KTlO2,
Ag3TlO3, Ва2Тl2О5. Гидроксид
Т12О3·nН2О-бурое аморфное вещество;
малоустойчив; почти не раств. в воде (3·10-8% по массе при 20 °С),
медленно раств. в минер, к-тах; осаждается из растворов солей Tl(III) при рН
2-4,5. 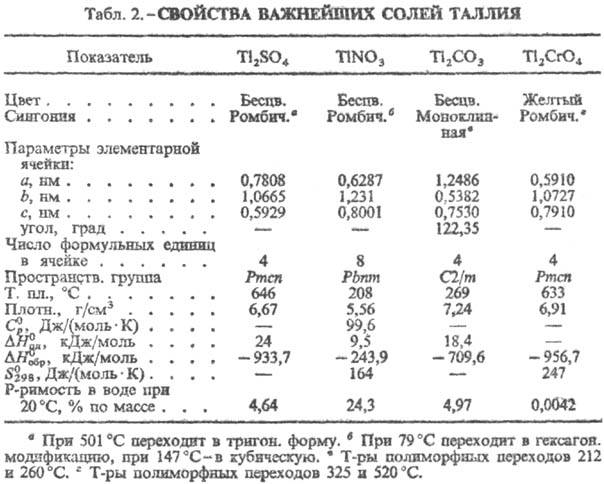
Сульфид Tl2S
осаждается в виде черного осадка при действии H2S или (NH4)2S
на нейтральные, щелочные или слабокислые р-ры солей Т.; плохо раств. в воде
(0,02% по массе при 20 °С), уксусной и щавелевой к-тах, р-рах щелочей, соды,
сульфидов щелочных металлов, минер, к-тами разлагается. Сульфид, полученный
сплавлением Тl и S,-мягкие голубовато-черные слоистые кристаллы тритон. сингонии
(а — 1,220 нм, с = 1,817 нм, z = 27, пространств. группа
Получение. Осн.
источники Т.-промежут. продукты я отходы кадмиевого произ-ва, пыли свинцово-медеплавильных
заводов и пиритные огарки. Обогащение Т. достигается обжигом в окислит. или
восстановит. атмосфере, а также хлорирующим обжигом с добавкой NaCl или КСl.
Из обогащенных возгонов Т. выщелачивается водой, разб. р-рами соды или H2SO4.
Иногда применяют предварит. сульфатизацию. Для концентрирования таллиисодержащих
р-ров и отделения Tl от Cd и др. сопутствующих элементов используют
экстракцию, напр. йодным р-ром трибутил-фосфата в керосине в присут. восстановителя
(SO2) с послед. реэкстракцией разб. H2SO4 в
присут. окислителя (Н2О2). Из щелочных р-ров концентрирование
производится сорбцией на катионитах. Таллиевые концентраты получают осаждением
малорастворимых соед.-ТlСl, Тl2СrO4, T12О3·nH2О
и др., а также цементацией на Zn или Zn- либо Cd-амаль-гаме. Металлический Т.
получают цементацией на цинковых листах или электролизом сульфатных р-ров. Очищают Т. переплавкой
под слоем щелочи с добавлением окислителя (KNO3 или NaNO3)
и продувкой воздуха, электролизом с р-римым анодом в сульфатном электролите.
Применяют также амальгамный многосекционный электролиз с использованием сернокислотного,
щелочного с добавкой трилона Б или перхлоратного электролита. Окончат. очистка
достигается зонной плавкой или вытягиванием монокристаллов из расплава. Определение. Наиб.
надежный метод качеств. определения Т.-спектральный (по линии 535,0 нм). Применяют
также р-ции образования малорастворимых соед.-иодида (желтый осадок), иодовисмутата
(красный) и др. Количественно Т. определяют: гравиметрически-осаждением тионалидом
(2-меркапто-N-2-нафтилацетамид), титриметрически - титрованием Т1(I) окислителями
(перманганатом, броматом, иодатом К), амперометрическим титрованием р-рами К2СrO4
или KI, комплексометрич. титрованием; фотоколо-риметрически-чаще с использованием
р-ции галогенидных комплексов Т1(III) с красителями (метилфиолетовым, родамином
Б или С, бриллиантовым зеленым). Применяются также полярографич., пламенно-фотометрич.
и др. методы. Применение. Металлический
Т. используют в осн. для произ-ва подшипниковых и кислотоупорных сплавов (на
основе Рb и Sn). Амальгаму Т. [т. пл. для эвтектики Hg-Tl (8,55 ат. % Т.) —
59°С] применяют в термометрах для низких т-р. Радиоизотоп 204Т1
(Т1/2 3,56 г) используют в качестве источника b-излучения. Галогениды Т. и их твердые
р-ры применяют для изготовления линз и др. деталей приборов ИК техники, легирования
кристаллов галогенидов щелочных металлов (для сцинтилляц. счетчиков), наполнения
газоразрядных ламп зеленого света. Халькогениды Т. входят в состав разл. полупроводников,
в частности стеклообразных. Сульфид Т. применяют для изготовления фотосопротивлений.
Соли (нитрат, карбонат) используют в произ-ве оптич. стекла. Формиат и малонат
Т.-компоненты тяжелых жидкостей (жидкость Клеричи), используемых для минералогич.
исследований. Сложные оксиды, напр. Т1Ва2Са3Сu4О11,-высокотемпературные
сверхпроводники. Мировое произ-во Т. (без
СНГ) 12-15 т/год. Осн. производители: ФРГ, США, Канада, Франция, Бельгия. Как сам Т., так и его соед.
высокотоксичны. Симптомы отравления-поражение нервной системы, почек, желудка,
выпадение волос. ПДК в воде для Т. 0,0001 мг/м3, для бромида, иодида,
карбоната (в пересчете на Т.) в воздухе рабочей зоны 0,01 мг/м3,
в атм. воздухе 0,004 мг/м3. Хранят Т. под слоем прокипяченной
дистиллированной воды либо парафина или покрывают лаком. Т. открыт спектроскопически
У. Круксом в 1861 и получил назв. по цвету своей спектральной линии. Металлический
Т. получен в том же году независимо В. Лями. Лит.: Коренман И.
М., Аналитическая химия таллия, М.7 1960; Григорович А.Н., Таллий и его промышленное
получение, А.-А., 1960; Куль-ба Ф. Я., Миронов В. Е., Химия таллия. (Комплексные
соединения), Л., 1963; Федоров П. И., в кн.: Химия и технология редких и рассеянных
элементов, под ред. К.А.Большакова, т. 1, 2 изд., М., 1976, с. 325-66; Федоров
П. И., Мохосоев М. В., Алексеев Ф. П., Химия галлия, индия и таллия, Новосиб.,
1977; Lee A. G., The chemistry of thallium, Amst, 1971 (Topics in inorganic
and general chemistry, v. 14). П. И. Федоров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ТАЙРОН
будет выглядеть так: Что такое ТАЙРОН
 10,36
кДж/моль); при давлении 3,67 ГПа и 25 °С Тl I превращ. в модификацию III
с гранецентрир. кубич. решеткой, а = 0,4778 нм, z = 4, пространств.
группа Fт3т. Т. пл. 303 °С, т. кип. 1475 °С, при давлении
~5 ГПа т. пл. 500 °С; плотн. 11,849 г/см3, жидкого 11,289 г/см3
(306 °С);
10,36
кДж/моль); при давлении 3,67 ГПа и 25 °С Тl I превращ. в модификацию III
с гранецентрир. кубич. решеткой, а = 0,4778 нм, z = 4, пространств.
группа Fт3т. Т. пл. 303 °С, т. кип. 1475 °С, при давлении
~5 ГПа т. пл. 500 °С; плотн. 11,849 г/см3, жидкого 11,289 г/см3
(306 °С);  26,3 Дж/(моль·К); DHпл 4,2кДж/моль, DHисп
181,4 кДж/моль (0 К);
26,3 Дж/(моль·К); DHпл 4,2кДж/моль, DHисп
181,4 кДж/моль (0 К); 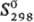 64,3 Дж/(моль · К); ур-ния температурной зависимости давления пара: lgр(мм
рт. ст.) = 9,902-9511 /Т + 0,1471g Т + 0,756 x x 10-3T
(298-576 К), lgp(MM рт.ст.) = 9,819 - 9091/T+ +0,5361gТ (576-1648
К); температурный коэф. линейного расширения 28·10-6 К-1
(293 К); теплопроводность 38,9 Вт/(м·К) (293 К); r0,15·10-6
Ом·м, температурный коэф. r 5,177·10-3 K-1 (273
К); т-ра перехода в сверхпроводящее состояние 2,39 К; диамагнитен, x
—0,249·10-9. Твердость по Моосу 1,3, по Бринеллю 20 МПа; модуль нормальной
упругости 7,95 ГПа (20 °С), sраст 10 МПа; относит. удлинение
40%; пластичен.
64,3 Дж/(моль · К); ур-ния температурной зависимости давления пара: lgр(мм
рт. ст.) = 9,902-9511 /Т + 0,1471g Т + 0,756 x x 10-3T
(298-576 К), lgp(MM рт.ст.) = 9,819 - 9091/T+ +0,5361gТ (576-1648
К); температурный коэф. линейного расширения 28·10-6 К-1
(293 К); теплопроводность 38,9 Вт/(м·К) (293 К); r0,15·10-6
Ом·м, температурный коэф. r 5,177·10-3 K-1 (273
К); т-ра перехода в сверхпроводящее состояние 2,39 К; диамагнитен, x
—0,249·10-9. Твердость по Моосу 1,3, по Бринеллю 20 МПа; модуль нормальной
упругости 7,95 ГПа (20 °С), sраст 10 МПа; относит. удлинение
40%; пластичен.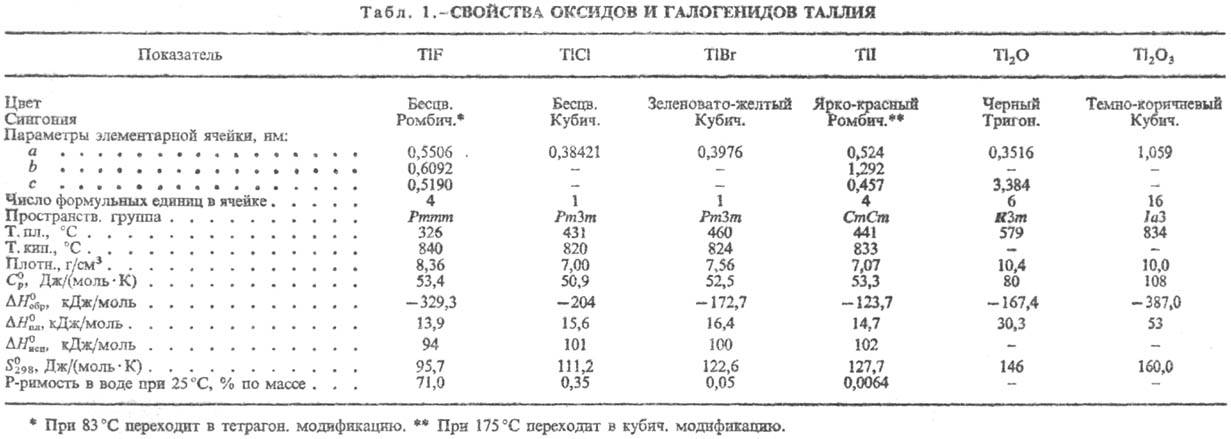
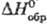 — 233 кДж/моль; растворяется в воде (20,3% по массе при 0°С, 59,8% при 100
°С), этаноле, обладает щелочными Свойствами.
— 233 кДж/моль; растворяется в воде (20,3% по массе при 0°С, 59,8% при 100
°С), этаноле, обладает щелочными Свойствами.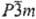 ); т. пл. 449 °С, т. кип. 1177°С; плотн. 8,46 г/см3;
); т. пл. 449 °С, т. кип. 1177°С; плотн. 8,46 г/см3;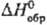 — 88 кДж/моль; на воздухе, особенно в присут. влаги, легко окисляется. См. также
— 88 кДж/моль; на воздухе, особенно в присут. влаги, легко окисляется. См. также