Химическая энциклопедия
"СТЕКЛО НЕОРГАНИЧЕСКОЕ"
Главная - Химическая энциклопедия - буква С - СТЕКЛО НЕОРГАНИЧЕСКОЕ
СТЕКЛО НЕОРГАНИЧЕСКОЕ
,
твердый аморфный материал, получающийся в результате переохлаждения жидкости
(напр., расплава неорг. оксидов, водного р-ра солей, жидкого металлич. сплава).
Обладает мех. св-вами твердого тела, характеризуется термодинамич. метастабильностью;
при определенных условиях склонно к кристаллизации. Отличается от кристаллов
и жидкостей: С. н. рентгеноаморфно вследствие неупорядоченного атомного строения
(в его структуре отсутствует дальний порядок), изотропно, не имеет определенной
т-ры затвердевания или плавления, т. е. при охлаждении расплав переходит из
жидкого состояния сначала в пластичное, а затем в твердое (процесс стеклования).
Процессы нагревания и охлаждения (если при охлаждении не происходит кристаллизации)
обратимы. Температурный интервал Tf - Тg, в
пределах к-рого происходят эти процессы, наз. интервалом стеклования (Tf-т-ра
перехода из жидкого состояния в пластичное, Тg-т-ра перехода
из пластичного состояния в твердое). Интервал стеклования (обычно 100-200 °С)
зависит от хим. состава и скорости охлаждения С. н. и представляет собой переходную
область, в пределах к-рой происходит резкое изменение его св-в. В С. н. существуют
образования (рои, кластеры или атомные комплексы) с размерами от 0,5 до 2 нм
и разл. включения технол. или ликвационного происхождения от 5,0 до 100,0 нм. Классификация стекол. С.
н. различают по составу и назначению. По составу выделяют одно- или многокомпонентные
С. н., состоящие из разл. элементов (металлы, неметаллы), галогенидов, халькогенидов,
оксидов и др. Од-нокомпонентные элементные С. н. способны образовывать небольшое
число неметаллов - S, Se, As, P, С и нек-рые металлы-Bi, Ca, Zn, Hf, V,
Nb, Та, Сr, Mo, W, Re, Fe, Ni, Al и др. Однокомпонентные галогенидные С. н.
получают гл. обр. на основе стеклообразующего компонента-BeF2, ZrF4
или BaF2; многокомпонентные составы фторберилатных стекол содержат
также фториды Al, Ga, Mg, Sr, Ba. Многокомпонентные промышленные С. н. на основе
хлоридов, бромидов и иодидов разл. металлов могут иметь след. состав (% по массе):
КХ 0-24.С, РbХ 0-24,0, SrX 2,0-30,0, CdX 34,0-53,0, ВаХ 8,0-40,0, РbХ2
0-23,0 (X = Cl, Br, I). Халько-генидные С. н. содержат бескислородные системы
типа As-X, Ge-As-X, Ge-Sb-X, Ge-P-X, где X = S, Se, Те. Состав пром. халькогенидных
С. н. (% по массе): Те 85,0-87,0, Se 9,0-11,0, As 1,0-1,6, Sb 2,0-3,0, S 0,5
- 1,0. Оксидные С.н. образуют SiO2, GeO2, В2О3,
Р2О5, As2O3. Большая группа оксидов-ТеО2,
TiO2r МоО3, WO3, Bi2O3,
A12O3, Ga2O3, V2O5-образует
С.н. при сплавлении с др. модифицирующими оксидами, напр. CaO, Na2O
и т.д. Оксидные С.н. называют по виду стеклообразующего оксида: силикатные,
боратные, фосфатные, германатные и т.д. Из однокомпонентных С.н.
наиб. значение имеет силикатное стекло кварцевое
, из бинарных-щелочносиликатные
С. н. состава M2O-SiO2 (М = Na, К), т. наз. стекло растворимое
, из многокомпонентных - щелочносиликатные С.н., содержащие оксиды
Ca, Mg, Al. Хим. состав нек-рых видов оксидных промышленных С.н. приведен в
таблице. По назначению промышленные
С.н. разделяют на неск. видов: строительное (листовое-оконное, витринное, узорчатое,
армированное; архитектурно-строительное - блоки, пакеты, профилированное С.н.,
пеностекло; стеклянные.трубы); -техническое (оптич., хим.-лаб., мед., электротехн.,
све-тотехн., электроизоляц. и т.д.); стекловолокно; тарное; сортовое (для произ-ва
стеклянной посуды); специальное (лазерное, фотохромное, оптически- и магнитоактивное,
для ультразвуковых линий задержки и т.д.); стекло жидкое
; эмали и покрытия;
ситаллы
. Физико-химические свойства
и применение. Оптические св-ва. С.н. отличаются прозрачностью в разл. областях
спектра. Оксидные С.н. характеризуются высокой прозрачностью в видимой области
спектра: коэф. прозрачности т(т = I/I0, где
I0 - интенсивность падающего на пов-сть стекла света, I-интенсивность
света, прошедшего сквозь стекло) для оконного С.н. 0,83-0,90, для оптического-0,95-0,99. В связи с этим С.н. незаменимо
при остеклении зданий и разл. видов транспорта, изготовлении зеркал и оптич.
приборов, включая лазерные, лаб. посуды, ламп разл. ассортимента и назначения,
осветит. аппаратуры, телевизионной техники, волоконно-оптич. линий связи, хим.
аппаратуры. В зависимости от состава
и условий получения С.н. способно по-разному преломлять, рассеивать и поглощать
свет в видимой, УФ, ИК и рентгеновской областях спектра (см. Оптические материалы
),
Нек-рым С.н. свойственна также фоточувствительность, т. е. способность изменять
коэф. поглощения под действием УФ или рентгеновского облучения, a-лучей,
нейтронов, что используют в произ-ве т. наз. фотохромных С. н., а также при
изготовлении аппаратуры и приборов для радиац. техники. Наиб. высоким светопропусканием
в ИК области обладают алюмофосфат-ные и халькогенидные С.н., повышенным-С.н.
на основе SiO2; УФ лучи интенсивно поглощают С.н., содержащие оксиды
Pb, Fe, Ti, рентгеновские и a-лучи-С.н. с высоким содержанием оксидов Рb
или Ва. Галогенидные С.н. на основе
BeF2 отличаются уникальным комплексом оптич. постоянных, высокой
устойчивостью к действию жестких излучений и агрессивных сред, таких, как F2,
HF. С. н. на основе фторидов Zr и Ва прозрачны в видимой и ИК областях спектра.
Халькогенидные С.н. обладают также электронной проводимостью; применяются в
телевизионных высокочувствит. камерах, ЭВМ (в качестве переключателей или элементов
запоминающих устройств). Плотность промышленных
С.н. колеблется от 2,2 до 8,0 г/см3. Низкие значения плотности характерны
для бо-ратных и боросиликатных С.н.; среди силикатных С.н. наим. плотностью
обладает кварцевое. Введение в состав С. н. щелочных и щел.-зем. оксидов приводит
к увеличению его плотности: плотность возрастает при эквимолекулярной замене
одного оксида другим в рядах Li2O < Na2O < К2О
и MgO < CaO < SrO < ВаО < РbО. Плотность последних С. н. достигает
8,0 г/см3. Мех. св-ва. С. н.-хрупкий
материал, не обладает пластич. деформацией, весьма чувствителен к мех. воздействиям,
особенно ударным. Значение модуля упругости различных С.н. колеблется в пределах
44,2-87,2 ГПа. Наибольшее его значение характерно для малощелочных алюмосиликатных
С. н. с высоким содержанием оксидов Be, Mg и Ca, наименьшее-для боро- и свинцовосиликатных
С.н. с высоким содержанием оксидов В и Рb; модуль упругости кварцевого С. н.
73,2 ГПа. Ударная вязкость силикатных С. н. 1,5-2,0 кН/м, в то же время сопротивление
сжатию такое же, как у чугуна,-0,5-2,5 ГПа. Прочность С.н. на изгиб
30-120 МПа. Техн. прочность определяется качеством пов-сти (наличие трещин Гриф-фитса). Упрочняют С.н. обычно способами,
способствующими созданию в нем поверхностных сжимающих напряжений (отжиг, термич.
закалка, хим. упрочнение), причем прочность закаленного С.н. в 4-6 раз превышает
прочность отожженного. Хим. способы упрочнения-обработка пов-сти С.н. газовыми
реагентами (напр., SO3), ионный обмен (обработка пов-сти в расплавах
солей щелочных металлов), поверхностная кристаллизация, нанесение полимерных
и др. покрытий. Возможно также упрочнение травлением, т.е. путем удаления или
"залечивания" дефектов при обработке пов-сти С.н. разл. хим. реагентами.
Так, напр., sизг для пром. листового стекла после действия фтористоводородной
к-ты составляет 500-600 МПа. При низкотемпературном
(400-450°С) ионном обмене эффект упрочнения достигается вследствие замещения
ионов одних щелочных металлов на, ионы др. щелочных металлов большего радиуса
(напр., Li+ на Na+ или К+), в результате чего
образуется сжатый поверхностный слой (порядка 20-40 мкм). При высокотемпературном
(500-700°С) ионном обмене происходит замена катионов Na+ и К+
в С. н. на Li+, что снижает его коэф. температурного расширения;
при этом в поверхностном слое при охлаждении образуются напряжения сжатия, что
увеличивает прочность С. н. в 2,0-2,5 раза, а его термостойкость в 1,5-2,0 раза. 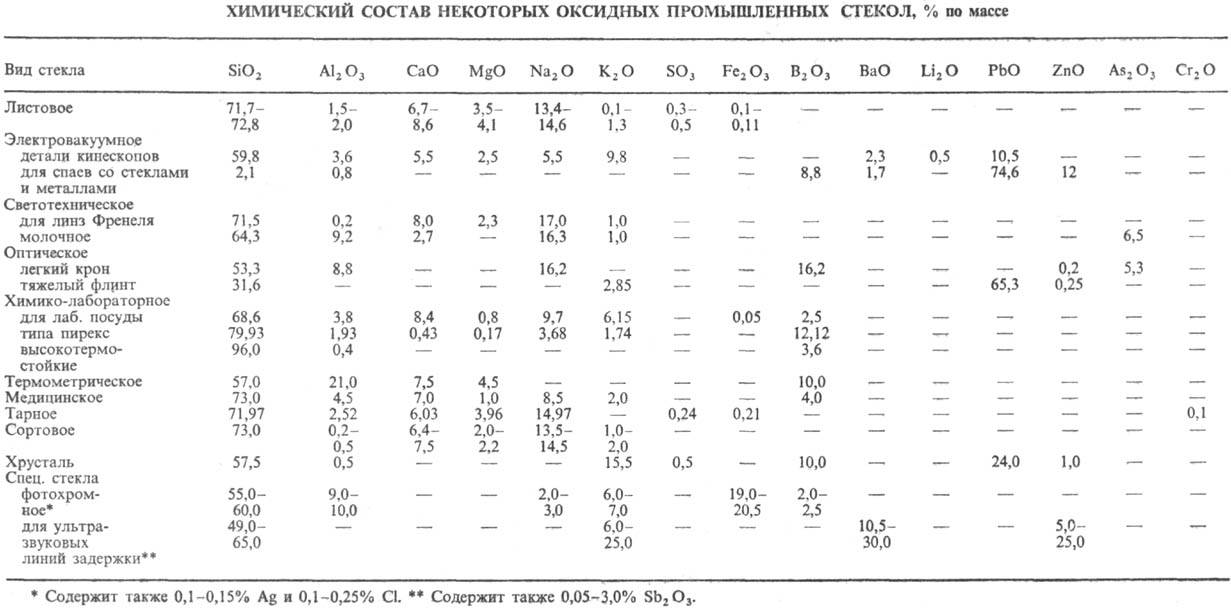
При термин, обработке С.
н. при 700-1000°С упрочняющий эффект достигается вследствие поверхностной
кристаллизации. Электрич. св-ва С.н. зависят
от состава и т-ры среды-С. н. могут быть диэлектриками, полупроводниками или
проводниками. Большая группа оксидных С. н. (силикатные, боратные, фосфатные)
относится к классу изоляторов; почти идеальный изолятор - кварцевое С. н. Поскольку
носители тока в оксидных С.н.-катионы щелочных и щел.-зем. металлов, электропроводность,
как правило, возрастает с увеличением их содержания в С. н. и повышением т-ры.
Стеклянные изоляторы используют для высоковольтных линий электропередач. Пригодность
электротехнических С. н. для работы в тех или иных температурных условиях зависит
от их состава и оценивается по т-ре (ТК100), при к-рой С. н. имеет
уд. электрич. проводимость 1,00·10-6 См·м-1. Для кварцевого
стекла ТК100600°С, для других, используемых в электротехн. пром-сти,-230-520°С. Диэлектрич. проницаемость
e обычных промышленных С. н. невелика, причем самое низкое значение у кварцевого
С. н. и стеклообразного В2О3 (3,8-4,0). С увеличением
содержания в С. н. ионов щелочных и тяжелых металлов (Ва, Рb), обладающих высокой
поляризуемостью, e повышается в силу влияния ионной поляризации. Возрастает
она также с повышением т-ры выше 200 °С и при действии частот до 50 Гц.
Диэлектрич. потери наиб. низки для силикатных С. н., для кварцевого С.н. при
20°С и частоте 10-10 Гц tgd 0,0001. Для закаленных С.н.
tgd в 1,5-2,0 раза выше, чем для отожженных. Электрич. прочность С.н. (пробивное
напряжение) в однородном электрич. поле достигает высоких значений (104-105
кВ·м-1). Термич. св-ва. Для обычных
силикатных стекол термостойкость 60-100°С, для пирекса-280°С, для кварцевого
стекла-ок. 1000°С. Для силикатных С.н. коэф. теплопроводности 0,6-1,34 Вт/(м·°С),
уд. теплоемкость при комнатной т-ре 0,3-1,05 кДж/(кг · К), коэф. линейного термич.
расширения 5·10-7-120·10-7 К-1 (последнее значение-для
свинецсодержащих С. н.). Хим. стойкость С.н. характеризуется
высокой стойкостью к действию влажной атмосферы, воды, к-т (HF, Н3РО4).
Различают 4 гидролитич. класса хим. стойкости, оцениваемой по кол-ву щелочей
и др. р-римых компонентов, перешедших
в р-р при кипячении С. н. в воде или р-рах к-т. Наиб. хим. стойкостью обладают
кварцевое, боросиликат-ное (не более 17% В2О3) и алюмосиликатное
С.н. Хим. стойкость С.н. существенно возрастает также и при введении в состав
оксидов Ti, Zr, Nb, Та, Sn. Стойкость С.н. к реагентам с рН < 7 повышают
путем спец. обработки или защиты пов-сти пленками кремнийорг. соединений, фторидами
Mg, оксидами А1 и Zn. По убыванию интенсивности разрушающего действия на С.н.
хим: реагенты располагаются в след. ряд: HF > Н3РО4
> р-ры щелочей > р-ры щелочных карбонатов > НСl = H2SO4
> вода. Макс. потеря массы С. н. на 100 см2 пов-сти в р-рах к-т
(кроме HF, Н3РО4) составляет ок. 1,5 мг, в то время как
в щелочных средах возрастает до 150 мг. Получение стекла. Традиц.
технология пром. способа получения С. н. состоит в подготовке сырьевых материалов
(дробление, сушка, просеивание), приготовлении шихты (дозирование сырьевых компонентов
и их смешивание), варке, формовании изделий, отжиге, обработке (термич., хим.,
мех.). В зависимости от назначения
С. н. сырье для его изготовления содержит разл. оксиды и минералы. Кремнезем,
являющийся главной составной частью С.н., вводят в шихту в виде кварцевого песка
или- молотого кварца (вредные примеси-соед. Сr и Fe, придающие С.н. желтовато-зеленый
и зеленый цвет). Для варки высококачеств. бесцветных С. н. песок очищают физ.
и хим. способами; размер зерен песка 0,2-0,5 мм. В2О3
в шихту вводят в виде буры или Н3ВО3, Р2О5-в
виде фосфатов или Н3РО4, Аl2О3-в
виде глинозема, каолина, глины, полевого шпата или Аl(ОН)3, Na2O-B
виде Na2CO3, К2О-в виде К2СО3
или KNO3, СаО-в виде мела или известняка, ВаО-в виде ВаСО3,
Ba(NO3)2 или BaSO4, MgO-в виде доломита или
магнезита, Li2O-B виде Li2СО3 и прир. минералов
лепидолита или сподумена, РbО-в виде сурика, глета или силиката Рb. Вспомогат. материалы шихты
- осветлители, обесцвечива-тели, красители, глушители, восстановители и др.
В качестве осветлителей применяют небольшие кол-ва (NH4),SO4,
Na2SO4, NaCl, As2O3 и As2O5
в сочетании с (NH4)2NO3, плавиковый шпат. Нек-рые
из них одновременно являются и обесцвечивателями - окисляют в С.н. соед. Fe.
Иногда для обесцвечивания в шихту вводят небольшие кол-ва в-в, окрашивающих
стекломассу в дополнительный к зеленому цвет (Se, соед. Со, Мh
и др.). Окрашивают С. н., добавляя в шихту красящие в-ва. Желтую окраску С.
н. придают СrО3, NiO, Fe2O3, зеленую-Сr2О3
и СиО, синюю-СuО и СоО, фиолетовую - NiO и Мn2О3, розовую-СоО,
МnО и Se, коричневую - Fe2O3, FeS, красно-рубиновую -
коллоидные Си и Аи. Процесс стекловарения -процесс
получения однородного расплава - условно разделяют на неск. стадий: образование
силикатов, стеклообразование, осветление, гомогенизация, охлаждение. Варку С. н. проводят в
печах непрерывного действия разл. типа-электрич., газопламенных, газопламенных
с дополнит. электроподогревом. На первой стадии вследствие плавления эвтектич.
смесей и солей происходит образование силикатов и др. промежут. соединений,
появляется жидкая фаза. Силикаты и непрореагировавшие компоненты вместе с жидкой
фазой представляют собой на этой стадии плотную спекшуюся массу. Для большинства
силикатных С.н. первый этап завершается при 1100-1200 °С. На стадии стек-лообразования
при 1200-1250 °С растворяются остатки шихты, происходит взаимное растворение
силикатов, удаляется пена и образуется относительно однородная стекломасса,
насыщенная, однако, газовыми включениями, поскольку обычно шихта силикатных
С.н. содержит ок. 18% химически связанных газов (СО2, SO2,
O2 и др.). На стадии осветления (1500-1600 °С, длительность-до
неск. суток) происходит удаление из расплава газовых пузырей. Для ускорения
процесса используют добавки, снижающие поверхностное натяжение массы. Одновременно
с осветлением идет гомогенизация -усреднение расплава по составу. Наиб. интенсивно
гомогенизация Осуществляется при мех. перемешивании стекломассы мешалками из
огнеупорных материалов. На стадии охлаждения проводят подготовку стекломассы
к формованию, для чего равномерно снижают т-ру на 400-500°С и достигают
необходимой вязкости С.н. Формование изделий из стекломассы осуществляют разл.
методами - прокатом, прессованием, прессвыдуванием, выдуванием, вытягиванием
и др. на спец. стеклоформующих машинах. Прессование применяют в
произ-ве стеклянной тары, архитектурных деталей, посуды; выдувание-в произ-ве
узкогорлой тары, сортовой (столовой) посуды, электровакуумных изделий; прессвыдувание-в
машинном произ-ве ши-рокогорлой посуды; вытягивание-при изготовлении оконного
и техн. листового С.н., трубок, труб, стержней, стеклянных волокон; прокатка-при
произ-ве листового С.н. разл. видов, преим. строительного толщиной 3 мм
и более. Др. методы: отливка в формы при изготовлении крупногабаритных предметов,
моллирование - получение изделий в форме при нагр. твердых кусочков С. н. При произ-ве пеностекла
в шихту (или тонкоизмельченный стеклянный бой) добавляют парообразователи,
выделяющие при варке стекла газ и вспучивающие стеклянную массу. Вспенивают
стекло при 700-800 °С (для обычной шихты) или 950-1150 °С (для шихты
из глин, горных пород, нерудных ископаемых). Помимо традиц. метода получения
применяют новые-в частности золь-гель процесс
, позволяющий при значительно
более низких т-рах получать С. н. высокой чистоты и однородности. Существуют
три осн. варианта практич.. реализации этого метода. Суть первого-приготовление
р-ров на основе особо чистых р-римых сырьевых материалов (солей и гидрооксидов
металлов, металлоорг. соед.); переход от р-ра к золю, а затем гелю, высушивание
геля с образованием аморфной порошкообразной шихты, ее плавление с образованием
стекла. Второй метод - поликонденсация
(полимеризация) гелей, послед. их уплотнение при термич. обработке. Переход
золь-гель-стекло включает след. стадии: растворение исходных алкоксидов металлов
M(OR)n с образованием гомог. водных или орг. р-ров (М — Si,
Аl, В, Ва, Ti и т. д.; R-CH3, C2H5, С3Н7,
n-степень окисления металла), гидролиз алкоксидов и поликонденсация продуктов,
приводящая к образованию
золя, а затем твердого геля, по р-ции М(ОК)n + nН2О
: М(ОН)„ + nROH, сушка геля при нагр., переход геля в стекло. Третий метод заключается
в гелировании золей, приготовленных из коллоидных дисперсий оксидов. Описанным выше методом
получают заготовки, трубы и волокна для оптич. световодов и др. элементов волоконной
оптики. Металлич., халькогенидные
и галогенидные С. н. получают быстрым охлаждением расплавов (см. Стеклообразное состояние
). При этом часто используют сверхвысокие скорости охлаждения
(105-108 К/с). Историческая справка. Стеклоделие
впервые возникло в Египте и Месопотамии в 4-м тыс. до н. э. В 1 в. н. э. наиб.
крупный центр стеклоделия-Рим, с 9 до 17вв. н. э.-Венеция. В развитии стеклотехники
условно выделяют 4 периода: в 4-2-м тыс. до н. э. из С. н. делали украшения
и предметы религиозного культа, во 2-1-м тыс. до н. э.-небольшие сосуды; 1-е
тыс. до н. э. началось с изобретения стеклодувной трубки, что позволило стеклоделию
достичь большой высоты, а С. н. превратить в материал широкого потребления;
нач. 19-кон. 20 вв. характеризуется распространением машинной техники, созданием
многочисл. составов С.н. и проникновением его во все области быта, науки и техники.
В России стеклоделие развивалось с 10-11 вв. Основоположник научного стеклоделия
в России-М. В. Ломоносов, организовавший первую научную лабораторию по переработке
стекла. Первый стекольный завод в России построен в 1635. Лит.: Роусон Г., Неорганические стеклообразующие системы, пер. с англ., М., 1970; Аппен А. А., Химия стекла, 2 изд., Л., 1974; Лазерные фосфатные стекла, М.,-1980; Борисова 3. У., Халькогенидные полупроводниковые стекла, Л., 1983; Химическая технология стекла и ситаллов, М., 1983; Фельц А., Аморфные и стеклообразные неорганические твердые тела, пер. с нем., М., 1986; Неорганические стекла и изделия на их основе для волоконно-оптических систем связи и датчиков, в сб.: Итоги науки и техники, сер. Технология силикатных и тугоплавких неметаллических материалов, т. 2, М., 1989; Physilische Chemie der Glasoherflache, Lpz., 1981; Shufflebotham P.K., "J. of non-crystalline solids", 1987, v. 92, № 2-3, p. 183-244; Rawson Н„ "IEE Proc.", 1988, pt A, v. 135, № 6, p. 325-45. П.Д. Саркисов, Л. А. Орлова. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: СТЕКЛО НЕОРГАНИЧЕСКОЕ
будет выглядеть так: Что такое СТЕКЛО НЕОРГАНИЧЕСКОЕ