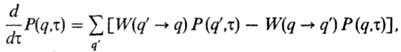Химическая энциклопедия
"СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА"
Главная - Химическая энциклопедия - буква С - СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
,
раздел стати-стич. физики, посвященный обоснованию законов термодинамики
на основе законов взаимод. и движения составляющих систему частиц. Для систем
в равновесном состоянии С. т. позволяет вычислять термодинамические потенциалы
,
записывать уравнения состояния
, условия фазовых и хим. равновесий.
Неравновесная С. т. дает обоснование соотношений термодинамики необратимых процессов
(ур-ний переноса энергии, импульса, массы и их граничных условий)
и позволяет вычислять входящие в ур-ния переноса кинетич. коэффициенты. С. т.
устанавливает количеств. связь между микро- и макросвойствами физ. и хим. систем.
Расчетные методы С. т. используются во всех направлениях совр. теоретич. химии. Основные понятия. Для
статистич. описания макроскопич. систем Дж. Гиббсом (1901) предложено использовать
понятия статистич. ансамбля и фазового пространства, что позволяет применять
к решению задач методы теории вероятности. Статистич. ансамбль-совокупность
очень большого числа одинаковых систем мн. частиц (т. е. "копий"
рассматриваемой системы), находящихся в одном и том же макросостоянии, к-рое
определяется параметрами состояния
; микросостояния системы при этом могут
различаться. Осн. статистич. ансамбли-микроканонич., канонич., большой канонич.
и изобарно-изотермический. Микроканонич. ансамбль
Гиббса используетя при рассмотрении изолированных систем (не обменивающихся
энергией E с окружающей средой), имеющих постоянный объем V
и число одинаковых частиц N (Е, V и N-
параметры состояния системы).
Канонич. ансамбль Гиббса используется для описания систем постоянного объема,
находящихся в тепловом равновесии с окружающей средой (абс. т-ра Т) при постоянном
числе частиц N (параметры состояния V, Т, N). Большой
канонич. ансамбль Гиббса используется для описания открытых систем, находящихся
в тепловом равновесии с окружающей средой (т-ра Т) и материальном равновесии
с резервуаром частиц (осуществляется обмен частицами всех сортов через "стенки",
окружающие систему объемом V). Параметры состояния такой системы-V,
Т и m—химический потенциал частиц. Изобарно-изотермич. ансамбль
Гиббса используется для описания систем, находящихся в тепловом и мех. равновесии
с окружающей средой при постоянном давлении P (параметры состояния
Т, P, N). Фазовое пространство в
статистич. механике-многомерное пространство, осями к-рого служат все обобщенные
координаты qi и сопряженные им импульсы pi(i
=1,2,..., М) системы с М степенями свободы. Для системы,
состоящей из N атомов, qi и pi соответствуют
декартовой координате Функция распределения
классич. системы f(p, q)характеризует плотность вероятности
реализации данного микросостояния
(р, q) в элементе объема dГ фазового пространства.
Вероятность пребывания N частиц в бесконечно малом объеме фазового пространства
равна: где dГN
- элемент фазового объема системы в единицах h3N,
h-постоянная Планка; делитель N! учитывает тот факт, что перестановка
тождеств. частиц не меняет состояния системы. Ф-ция распределения удовлетворяет
условию нормировки тf(p, q)dГN= 1,
т.к. система достоверно находится в к.-л. состоянии. Для квантовых систем ф-ция
распределения определяет вероятность wi,
N нахождения системы из N частиц в квантовом состоянии,
задаваемом набором квантовых чисел i, с энергией Ei,N при
условии нормировки Среднее значение Интегрирование по координатам
проводится по всему объему системы, а интегрирование по импульсам от — ,
до +,. Состояние термодинамич. равновесия системы следует рассматривать
как предел т:,. Для равновесных состояний ф-ции распределения
определяются без решения ур-ния движения составляющих систему частиц. Вид этих
ф-ций (одинаковый для классич. и квантовых систем) был установлен Дж. Гиббсом
(1901). В микроканонич. ансамбле
Гиббса все микросостояния с данной энергией Е равновероятны и ф-ция распределения
для классич. систем имеет вид: f(p,q)
= Ad[H(p,q)-E], где d-дельта-ф-ция
Дирака, Н(р,q)-ф-ция Гамильтона, представляющая собой сумму
кинетич. и потенц. энергий всех частиц; постоянная А определяется из
условия нормировки ф-ции f(p, q). Для квантовых систем
при точности задания квантового состояния, равной величине DE, в
соответствии с соотношением неопределенностей между энергией и временем (между
импульсом и координатой частицы), ф-ция w(Ek) =
[g(E, N, V)]-1, если Е S(E, N, V)
= klng(E, N, V), где k-Больцмана постоянная. В канонич. ансамбле Гиббса
вероятность нахождения системы в микросостоянии, определяемом координатами и
импульсами всех N частиц или значениями Ei,N, имеет
вид: f(p, q) = exp {[F - H(p, q)]/kT};
wi,N = exp[(F - Ei,N)/kT],
где F-своб.
энергия (энергия Гельмгольца), зависящая от значений V, Т, N: F = -kTlnZN, где ZN-статистич.
сумма (в случае квантовой системы) или статистич. интеграл (в случае классич.
системы), определяемые из условия нормировки ф-ций wi,N
или f(p, q): ZN = тexp[-H(р,
q)/kT]dpdq/(N!h3N) (сумма по г берется по
всем квантовым состояниям системы, а интегрирование проводится по всему фазовому
пространству). В большом канонич. ансамбле
Гиббса ф-ция распределения f(p, q) и статистич. сумма X,
определяемая из условия нормировки, имеют вид: где W-термодинамич.
потенциал, зависящий от переменных V, Т, m (суммирование ведется
по всем целым положит. N). В изобарно-изотермич. ансамбле
Гиббса ф-ция распределения и статистич. сумма Q, определяемая из условия
нормировки, имеют вид: где G-
энергия Гиббса
системы (изобарно-изотермич. потенциал, своб. энтальпия). Для вычисления термодинамич.
ф-ции можно использовать любое распределение: они эквивалентны друг другу и
соответствуют разным физ. условиям. Микроканонич. распределение Гиббса применяется
гл. обр. в теоретич. исследованиях. Для решения конкретных задач рассматривают
ансамбли, в к-рых есть обмен энергией со средой (канонич. и изобарно-изотермич.)
или обмен энергией и частицами (большой канонич. ансамбль). Последний особенно
удобен для изучения фазового и хим. равновесий. Статистич. суммы ZN
и Q позволяют определить энергию Гельмгольца F, энергию Гиббса G,
а также термодинамич. св-ва системы, получаемые дифференцированием статистич.
суммы по соответствующим параметрам (в расчете на 1 моль в-ва): внутр. энергию
U = RT2(9lnZN/9T)V,
энтальпию H = RT2(9lnQ/9T)P,
энтропию S = RlnZN + RT(9lnZN/9T)V
= = R ln Q + RT(9ln Q/9T)P,
теплоемкость при постоянном объеме СV = 2RT(9lnZN/9T)V
+ RT2(92 lnZN/9T2)V,
теплоемкость при постоянном давлении СР = 2RT (9lnZN/9T)P
+ + RT2(92lnZN/9T2)P
и т.д. Соотв. все эти величины приобретают и статистич. смысл. Так, внутренняя энергия
отождествляется со средней энергией системы, что позволяет рассматривать
первое начало термодинамики
как закон сохранения энергии при движении
составляющих систему частиц; своб. энергия связана со статистич. суммой системы,
энтропия-с числом микросостояний g в данном макросостоянии, или статистич.
весом макросостояния, и, следовательно, с его вероятностью. Смысл энтропии как
меры вероятности состояния сохраняется по отношению к произвольным (неравновесным)
состояниям. В состоянии равновесия энтропия изолир. системы имеет максимально
возможное значение при заданных внеш. условиях (Е, V, N), т. е. равновесное
состояние является наиб. вероятным состоянием (с макс. статистич. весом). Поэтому
переход из неравновесного состояния в равновесное есть процесс перехода из менее
вероятных состояний в более вероятное. В этом заключается статистич. смысл закона
возрастания энтропии, согласно к-рому энтропия замкнутой системы может только
увеличиваться (см. Второе начало термодинамики
). При т-ре абс. нуля любая
система находится в осн. состоянии, в к-ром w0 = 1 и S = 0. Это утверждение представляет собой третье начало термодинамики (см. Тепловая теорема
). Существенно, что для однозначного определения энтропии
нужно пользоваться квантовым описанием, т.к. в классич. статистике энтропия
м. б. определена только с точностью до произвольного слагаемого. Идеальные системы. Расчет
статистич. сумм большинства систем представляет сложную задачу. Она существенно
упрощается в случае газов, если вкладом потенц. энергии в полную энергию системы
можно пренебречь. В этом случае полная ф-ция распределения f(p, q)
для N частиц идеальной системы выражается через произведение одно-частичных
ф-ций распределения f1(p, q): Распределение частиц по
микросостояниям зависит от их кинетич. энергии и от квантовых св-в системы,
обусловленных тождественностью
частиц. В квантовой механике все частицы разделяются на два класса: фермионы
и бозоны. Тип статистики, к-рой подчиняются частицы, однозначно связан с их
спином. Статистика Ферми-Дирака
описывает распределение в системе тождеств. частиц с полуцелым спином 1/2,
3/2,... в единицах ђ = h/2p. Частица
(или квазичастица), подчиняющаяся указанной статистике, наз. фермионом. К фер-мионам
относятся электроны в атомах, металлах и полупроводниках, атомные ядра с нечетным
атомным номером, атомы с нечетной разностью атомного номера и числа электронов,
квазичастицы (напр., электроны и дырки в твердых телах) и т.д. Данная статистика
была предложена Э.Ферми в 1926; в том же году П.Дирак выяснил ее квантовомех.
смысл. Волновая ф-ция системы фермионов антисимметрична, т.е. меняет свой знак
при перестановке координат и спинов любой пары тождеств. частиц. В каждом квантовом
состоянии может находиться не более одной частицы (см. Паули принцип
).
Среднее число частиц ni идеального газа фермионов, находящихся
в состоянии с энергией Ei, определяется
ф-цией распределения Ферми-Дирака: ni={1+exp[(Ei-m)/kT]}-1, где i-набор квантовых
чисел, характеризующих состояние частицы. Статистика Бозе-Эйнштейна
описывает системы тождеств. частиц с нулевым или целочисленным спином (0, ђ,
2ђ, ...). Частица или квазичастица, подчиняющаяся указанной статистике,
наз. бозоном. Данная статистика была предложена Ш. Бозе (1924) для фотонов и
развита А. Эйнштейном (1924) применительно к молекулам идеального газа, рассматриваемым
как составные частицы из четного числа фермионов, напр. атомные ядра с четным
суммарным числом протонов и нейтронов (дейтрон, ядро 4Не и т.д.).
К бозонам относятся также фононы в твердом теле и жидком 4Не, экситоны
в полупроводниках и диэлектриках. Волновая ф-ция системы симметрична относительно
перестановки любой пары тождеств. частиц. Числа заполнения квантовых состояний
ничем не ограничены, т.е. в одном состоянии может находиться любое число частиц.
Среднее число частиц ni идеального газа бозонов, находящихся
в состоянии с энергией Еi описывается ф-цией распределения
Бозе-Эйнштейна: ni={exp[(Ei-m)/kT]-1}-1. Статистика Больцмана представляет
собой частный случай квантовой статистики, когда можно пренебречь квантовыми
эффектами (высокие т-ры). В ней рассматривается распределение частиц идеального
газа по импульсам и координатам в фазовом пространстве одной частицы, а не в
фазовом пространстве всех частиц, как в распределениях Гиббса. В качестве миним.
единицы объема фазового пространства, имеющего шесть измерений (три координаты
и три проекции импульса частицы), в соответствии с квантовомех. соотношением
неопределенностей, нельзя выбрать объем меньший, чем h3. Среднее
число частиц ni идеального газа, находящихся в состоянии с
энергией Ei, описывается ф-цией распределения Больцмана: ni=exp[(m-E
i)/kT]. Для частиц, к-рые движутся
по законам классич. механики во внеш. потенц. поле U(r), статистически
равновесная ф-ция распределения f1(p,r) по
импульсам p и координатам r частиц идеального газа имеет вид:
f1(p,r)
= A ехр{ - [р2/2m + U(r)]/kT}.
Здесь р2/2т-кинетич. энергия молекул массой ш,
постоянная А определяется из условия нормировки. Данное выражение часто
наз. распределением Максвелла-Больцмана, а распределением Больцмана наз. ф-цию n(r) = n0
ехр[-U(r)]/kT], где n(r)
= тf1(p, r)dp - плотность числа
частиц в точке r (n0-плотность числа частиц в отсутствие
внеш. поля). Распределение Больцмана описывает распределение молекул
в поле тяготения (барометрич. ф-ла), молекул и высокодисперсных частиц в поле
центробежных сил, электронов в невырожденных полупроводниках, а также используется
для расчета распределения ионов в разбавл. р-рах электролитов (в объеме и на
границе с электродом) и т. п. При U(r) = 0 из распределения
Максвелла - Больц-мана следует распределение Максвелла, описывающее распределение
по скоростям частиц, находящихся в ста-тистич. равновесии (Дж. Максвелл, 1859).
Согласно этому распределению, вероятное число молекул в единице объема Распределение Максвелла
не зависит от взаимод. между Частицами и справедливо не только для газов, но
и для жидкостей (если для них возможно классич. описание), а также для броуновских
частиц, взвешенных в жидкости и газе. Его используют для подсчета числа столкновений
молекул газа между собой в ходе хим. р-ции и с атомами пов-сти. Сумма по состояниям
молекулы. Статистич. сумма идеального газа в канонич. ансамбле Гиббса выражается
через сумму по состояниям одной молекулы Q1:
где Еi - энергияi-го квантового уровня молекулы (i = О соответствует
нулевому уровню молекулы), gi-статистич. вес i-го уровня.
В общем случае отдельные виды движения электронов, атомов и групп атомов в молекуле,
а также движение молекулы как целого взаимосвязаны, однако приближенно их можно
рассматривать как независимые. Тогда сумма по состояниям молекулы м. б. представлена
в виде произведения отдельных составляющих, связанных с по-ступат. движением
(Qпост) и с внутримол. движениями (Qвн): Q1 =
Qпост·Qвн, Qпост= l(V/N), где l = (2pmkТ/h2)3/2.
Для атомов Qвн представляет собой сумму по электронным
и ядерным состояниям атома; для молекул Qвн- сумма
по электронным, ядерным, колебат. и вращат. состояниям. В области т-р от 10
до 103 К обычно используют приближенное описание, в к-ром каждый
из указанных типов движения рассматривается независимо: Qвн
= Qэл·Qяд·Qвращ·Qкол/g,
где g - число симметрии, равное числу тождество. конфигураций, возникающих
при вращении молекулы, состоящей из одинаковых атомов или групп атомов. Сумма по состояниям электронного
движения Qэл равна статистич. весу Рт осн.
электронного состояния молекулы. Во мн. случаях осн. уровень невырожден и отделен
от ближайшего возбужденного уровня значит. энергией: (Рт = 1).
Однако в ряде случаев, напр. для молекулы О2, Рт =
з, в осн. состоянии момент кол-ва движения молекулы отличен от нуля и имеет
место вырождение энергетических уровней
, а энергии возбужденных состояний
м. б. достаточно низкими. Сумма по состояниям Qяд, обусловленная
вырождением ядерных спинов, равна:
где si-спин
ядра атома i, произведение беретсяпо всем атомам молекулы. Сумма по состояниям
колебат. движения молекулы
где vi-частоты нормальных
колебаний, При расчетах при т-рах
выше 103К необходимо учитывать ангармонизм колебаний атомов, эффекты
взаимод. колебат. и вращат. степеней свободы (см. Нежесткие молекулы
),
а также мультиплетности
электронных состояний, заселенности возбужденных
уровней и т. д. При низких т-рах (ниже 10 К) необходимо учитывать квантовые
эффекты (особенно для двухатомных молекул). Так, вращат. движение гетеро-ядерной
молекулы АВ описывается по ф-ле:
l-номервращат. состояния,
а для гомоядерных молекул А2(особенно для молекул водорода Н2,
дейтерия D2, трития Т2) ядерные и вращат. степени свободы
взаимод. друг с другом:
Qяд.вращ. Qяд·Qвращ. Знание суммы по состояниям
молекулы позволяет рассчитать термодинамич. св-ва идеального газа и смеси идеальных
газов, в т.ч. константы хим. равновесия, равновесную степень ионизации и т.п.
Важное значение в теории абс. скоростей р-ций имеет возможность расчета константы
равновесия процесса образования активир. комплекса (переходного состояния),
к-рое представляется как модифицир. частица, одна из колебат. степеней свободы
к-рой заменена степенью свободы поступат. движения. Неидеальные системы.
В реальных газах молекулы взаимод. друг с другом. В этом случае сумма по
состояниям ансамбля не сводится к произведению сумм по состояниям отдельных
молекул. Если считать, что межмол. взаимод. не влияют на внутр. состояния молекул,
статистич. сумма системы в классич. приближении для газа, состоящего из N тождеств. частиц, имеет вид:
где Здесь <2N-конфигурац.
интеграл, учитывающий взаимод. молекул. Наиб, часто потенц. энергия молекул
U рассматривается в виде суммы парных потенциалов: U = = Согласно т. наз. методу
групповых разложений, состояние системы рассматривается в виде совокупности
комплексов (групп), состоящих из разного числа молекул, и конфигурац. интеграл
распадается на совокупность групповых интегралов. Такой подход позволяет представить
любую термодинамич. ф-цию реального газа в виде ряда по степеням плотности.
Наиб. важное соотношение такого рода - вириальное ур-ние состояния. Для теоретич. описания
св-в плотных газов, жидкостей и твердых тел, р-ров неэлектролитов и электролитов
и границ раздела в этих системах более удобным, чем прямой расчет статистич.
суммы, является метод n-частичных ф-ций распределения. В нем вместо подсчета
статистич. веса каждого состояния с фиксир. энергией используют соотношения
между ф-циями распределения fn, к-рые характеризуют вероятность
нахождения частиц одновременно в точках пространства с координатами r1,...,
rn; при n = N fN =
b тf(p, r)dp (здесь и ниже qi
= ri). Одночастичная ф-ция f1(r1)
(n = 1) характеризует распределение плотности в-ва. Для твердого тела
это периодич. ф-ция с максимумами в узлах кристаллич. структуры; для газов или
жидкостей в отсутствие внеш. поля это постоянная величина, равная макроскопич.
плотности в-ва р. Двухчастичная ф-ция распределения (п = 2) характеризует
вероятность нахождения двух
частиц в точках 1 и 2, она определяет т. наз. корреляционную ф-цию g(|r1
— r2|) = f2(r1, r2)/r2,
характеризующую взаимную корреляцию в распределении частиц. Соответствующую
опытную информацию дает рентгеновский структурный анализ
. Ф-ции распределения размерности
n и n + 1 связаны бесконечной системой зацепляющихся интегродифференц.
ур-ний Боголюбова-Борна-Грина-Кирквуда-Ивона, решение к-рых чрезвычайно сложно,
поэтому эффекты корреляции между частицами учитывают введением разл. аппроксимаций,
к-рые определяют, каким бразом ф-ция fn выражается через
ф-ции меньшей размерности. Соотв. разработано неск. приближенных методов расчета
ф-ций fn, а через них-всех термодинамич. характеристик
рассматриваемой системы. Наиб. применение имеют приближения Перкус-Иевика и
гиперцепное. Решеточные модели конденсир.
состояния нашли широкое применение при термодинамич. рассмотрении практически
всех физ.-хим. задач. Весь объем системы разбивается на локальные области с
характерным размером порядка размера молекулы u0. В общем случае
в разных моделях размер локальной области м. б. как больше, так и меньше u0;
в большинстве случаев они совпадают. Переход к дискретному распределению молекул
в пространстве существенно упрощает подсчет разл. конфигураций молекул. Решеточные
модели учитывают взаимод. молекул друг с другом; энергия взаимод. описывается
энергетич. параметрами. В ряде случаев решеточные модели допускают точные решения,
что позволяет оценить характер используемых приближений. С их помощью возможно
рассмотрение многочастичных и специфич. взаимод., ориентац. эффектов и т. п.
Решеточные модели являются основными при изучении и проведении прикладных расчетов
растворов неэлектролитов
и полимеров, фазовых переходов
, критических явлений
, сильно неоднородных систем. Численные методы определения
термодинамич. св-в приобретают все большее значение по мере развития вычислит.
техники. В методе Монте-Карло осуществляется прямой расчет многомерных интегралов,
что позволяет непосредственно получить статистич. среднее наблюдаемой величины
А(r1.....rN) по любому из статистич.
ансамблей (напр.,
А - энергия системы). Так, в канонич. ансамбле термодинамич. среднее
имеет вид: Данный метод применим практически
ко всем системам; получаемые с его помощью средние величины для ограниченных
объемов (N = 102-105) служат хорошим приближением
для описания макроскопич. объектов и могут рассматриваться как точные результаты. В методе мол. динамики
эволюция состояния системы рассматривается с помощью численного интегрирования
ур-ний Ньютона для движения каждой частицы (N = = 102-105)
при заданных потенциалах межчастичного взаимодействия. Равновесные характеристики
системы получаются при усреднении по фазовым траекториям (по скоростям и координатам)
на больших временах, после установления максвелловского распределения частиц
по скоростям (т. наз. период термализации). Ограничения в использовании
численных методов в осн. определяются возможностями ЭВМ. Спец. вычислит. приемы
позволяют обходить сложности, связанные с тем, что рассматривается не реальная
система, а небольшой объем; это особенно важно при учете дальнодействующих потенциалов
взаимод., анализе фазовых переходов и т.п. Физическая кинетика - раздел
статистич. физики, к-рый дает обоснование соотношениям термодинамики необратимых
процессов, описывающим перенос энергии, импульса и массы, а также влияние на
эти процессы внеш. полей. Кинетич. коэффициенты-макроскопич. характеристики
сплошной среды, определяющие зависимости потоков физ. величин (теплоты, импульса,
массы компонентов и др.) от вызывающих
эти потоки градиентов т-ры, концентрации, гидродинамич. скорости и др. Необходимо
различать коэффициенты Онсагера, входящие в ур-ния, связывающие потоки с термодинамич.
силами (термодинамич. ур-ния движения), и коэффициенты переноса (диффузии, теплопроводности,
вязкости и т. п.), входящие в ур-ния переноса. Первые м. б. выражены через вторые
с помощью соотношений между макроскопич. характеристиками системы, поэтому в
дальнейшем будут рассматриваться лишь коэф. переноса. Для расчета макроскопич.
коэф. переноса необходимо провести усреднение по вероятностям реализаций элементарных
актов переноса с помощью неравновесной ф-ции распределения. Главная сложность
заключается в том, что аналит. вид ф-ции распределения f(р, q,
т) (т-время) неизвестен (в отличие от равновесного состояния системы,
к-рое описывается с помощью ф-ций распределения Гиббса, получаемых при т
: ,). Рассматривают n-частичные ф-ции распределения fn(r,
q, т), к-рые получают из ф-ций f(р, q, т)
усреднением по координатам и импульсам остальных (N — п) частиц: Для них м. б. составлена
система ур-ний, позволяющая описать произвольные неравновесные состояния. Решение
этой системы ур-ний очень сложно. Как правило, в кинетич. теории газов и газообразных
квазичастиц в твердом теле (фермионов и бозонов) используется лишь ур-ние для
одно-частичной ф-ции распределения f1. В предположении об отсутствии
корреляции между состояниями любых частиц (гипотеза мол. хаоса) получено т.
наз. кинетич. ур-ние БоЛьцмана (Л. Больцман, 1872). Это ур-ние учитывает изменение
ф-ции распределения частиц под действием внеш. силы F(r, т)
и парных столкновений между частицами: где f1(u,
r, т) и Если система находится
в статистич. равновесии, интеграл столкновений Stf равен нулю и решением
кинетич. ур-ния Больцмана будет распределение Максвелла. Для неравновесных состояний
решения кинетич. уравнения Больцмана обычно ищут в виде разложения в ряд ф-ции
f1(u, r, т) по малым параметрам относительно
ф-ции распределения Максвелла Данный подход реализуется
при исследовании процессов в газовых смесях, в многоатомных газах с учетом внутр.
степеней свободы молекул (колебат., вращат. и т.д.), в плотных газах, при изучении
влияния стенок сосудов на распределения молекул газа в приповерхностной области
и мн. др. задачах. Анализ решений кинетич. ур-ния Больц-мана позволяет обосновать
область применимости условия локального термодинамич. равновесия и определить
вклады в поток, обусловленные неравновесностью потока. Неравновесный поток импульса
дает сдвиговую вязкость; для газов с внутр. степенями свободы молекул он дополнительно
содержит член, обусловленный объемной вязкостью. Плотность потока энергии пропорциональна
градиенту т-ры (обычная теплопроводность), а в случае смеси газов она содержит
член, пропорциональный градиенту концентраций (эффект Дюфура). Поток в-ва в
смеси газов содержит член, пропорциональный градиенту концентрации (обычная
диффузия), и член, пропорциональный градиенту т-ры (термодиффузия). Физ. кинетика
дает для этих коэф. пропорциональности выражения через эффективные сечения столкновения,
следовательно через потенциалы межмол. взаимодействий. Коэф. переноса удовлетворяют
принципу симметрии, выражающему симметрию ур-ний механики относительно изменения
знака времени (теорема Онсагера). Для сильно разреженных
газов, когда длина своб. пробега молекулы l между двумя последоват. соударениями
значительно превосходит характерный размер системы L (1/L Кинетич. ур-ние Больцмана
для фононов кристаллич. решетки позволяет исследовать теплопроводность и поглощение
звука в диэлектриках, а кинетич. ур-ние Больцмана для электронов с учетом их
взаимод. с фононами-электрич. сопротивление и объясняет гальваномагн., термоэлектрич.,
термомагн. и др. явления в металлах, а также особенности поведения сверхпроводников
в высокочастотных полях. Для описания неравновесных
процессов в жидкостях од-ночастичная ф-ция распределения f1
не раскрывает специфики явлений и требуется рассмотрение двухчастичной ф-ции
распределения f2. Однако для достаточно медленных процессов
и в случаях, когда масштабы пространств. неодно-родностей значительно меньше
масштаба корреляции между частицами жидкости, можно использовать локально равновесную
одночастичную ф-цию распределения с т-рой, хим. потенциалами и гидродинамич.
скоростью, к-рые соответствуют рассматриваемому малому объему жидкости. К ней
можно найти поправку, пропорциональную градиентам т-ры, гидродинамич. скорости
и хим. потенциалам компонентов, и вычислить потоки импульсов, энергии и в-ва,
а также обосновать ур-ния Навье-Стокса, теплопроводности и диффузии. В этом
случае коэф. переноса оказываются пропорциональными пространственно-временным
корреляц. ф-циям потоков энергии, импульса и в-ва каждого компонента. Для описания процессов
переноса в-ва в твердых телах и на границах раздела с твердым телом широко используется
решеточная модель конденсир. фазы. Эволюция состояния системы описывается осн.
кинетич. ур-нием (master equation) относительно ф-ции распределения P(q,
т):
где P(q,т)= тf(p,q,т)du- ф-ция распределения, усредненная
по импульсам (скоростям) всех N частиц, описывающая распределение частиц
по узлам решеточной структуры (их число равно Ny, N < Ny),
q- номер узла или его координата. В модели "решеточного газа"
частица может находиться в узле (узел занят) или отсутствовать (узел свободен);
W(q :
q)-вероятность перехода системы в единицу времени из состояния q,
описываемого полным набором координат частиц, в др. состояние q. Первая
сумма описывает вклад всех процессов, в к-рых осуществляется переход в данное
состояние q, вторая сумма-выход из этого состояния. В случае равновесного
распределения частиц (т : ,) P(q) = exp[-H(q)/kT]/Q,
где Q-статистич. сумма, H(q)-энергия системы
в состоянии q. Вероятности перехода удовлетворяют детального равновесия принципу
: W(q:q)exp[-H(q)/kT]
= W(q : q)ехр[-H(q)/kТ]. На базе
ур-ний для функций P(q,т) строят кинетич. ур-ния для
n-частичных ф-ций распределения, к-рые получают путем усреднения по расположениям
всех остальных (N — п) частиц. Для малых h кинетич.
ур-ния м. б. решены аналитически или численно и с их помощью м. б. получены
коэф. диффузии, самодиффузии, сдвиговой вязкости, подвижности и т.п. Такой подход
применим к процессам переноса в-ва в моноатомных кристаллах, сплавах, оксидных
кристаллах, ионитах и т.д., к процессам переноса в-ва через границу с твердым
телом, роста кристаллов, фазовым превращениям и т. п. Для межфазного переноса,
из-за различий в характерных временах протекания элементарных процессов миграции
частиц, важную роль играет вид граничных условий на границах раздела фаз. Для малых систем (число
узлов Ny = 102 — 105) система ур-ний
относительно ф-ции P(q,т) м. б. решена численно методом
Монте-Карло. Этап релаксации системы к равновесному состоянию позволяет рассмотреть
разл. переходные процессы при исследовании кинетики фазовых превращений, роста
кристаллов, кинетики поверхностных р-ций и т.д. и определить их динамич. характеристики,
в т. ч. и коэф. переноса. Для расчета коэф. переноса
в газообразных, жидких и твердых фазах, а также на границах раздела фаз активно
используются разнообразные варианты метода мол. динамики, к-рый позволяет детально
проследить за эволюцией системы от времен ~10-15с до ~10-10с
(на временах порядка 10-10— 10-9с и более используются
т. наз. ур-ния Ланжевена, это ур-ния Ньютона, содержащие в правой части стохастич.
слагаемое). Для систем с хим. р-циями
на характер распределения частиц большое влияние оказывает соотношение между
характерными временами переноса реагентов и их хим. превращения. Если скорость
хим. превращения мала, распределение частиц не сильно отличается от случая,
когда р-ция отсутствует. Если скорость р-ции велика, ее влияние на характер
распределения частиц велико и использовать средние концентрации частиц (т.е.
ф-ции распределения с n = 1), как это делается при использовании закона
действующих масс, нельзя. Необходимо более детально описывать распределение
реагентов с помощью ф-ций распределения fn с n >
1. Важное значение при описании реакц. потоков частиц на пов-сти и скоростей
диффузионно-контролируемых реакций
имеют граничные условия (см. Макрокинетика
). Лит.: Кубо Р., Статистическая механика, пер. с англ., М.,1967; Зубарев Д. Н., Неравновесная статистическая термодинамика, М., 1971; Исихара А., Статистическая физика, пер. с англ., М., 1973; Ландау Л. Д., Лифшиц E. МL Статистическая физика, 3 изд., ч. 1, М., 1976; Ферцигер Дж., Капер Г., Математическая теория процессов переноса в газах, пер. с англ., М., 1976; Румер Ю. Б., Рывкин М. Ш., Термодинамика. Статистическая физика и кинетика, 2 изд., М., 1977; Смирнова H. А., Методы статистической термодинамики в физической химии, 2 изд., М., 1982; Берклеевский курс физики, пер. с англ., 3 изд., т. 5-Рейф Ф., Статистическая физика, М., 1986; Товбин Ю.К., Теория физико-химических процессов на границе газ-твердое тело, М., 1990. Ю.К. Товбин.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
будет выглядеть так: Что такое СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
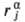 и
компоненте импульса
и
компоненте импульса 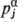 (a
= х, у, z) нек-рого атома j и М = 3N. Совокупность
координат и импульсов обозначаются q и p соответственно. Состояние
системы изображается точкой в фазовом пространстве размерности 2М, а
изменение состояния системы во времени-движением точки вдоль линии, наз. фазовой
траекторией. Для статистич. описания состояния системы вводятся понятия фазового
объема (элемента объема фазового пространства) и ф-ции распределения f(p,
q), к-рая характеризует плотность вероятности нахождения точки, изображающей
состояние системы, в элементе фазового пространства вблизи точки с координатами
р, q. В
(a
= х, у, z) нек-рого атома j и М = 3N. Совокупность
координат и импульсов обозначаются q и p соответственно. Состояние
системы изображается точкой в фазовом пространстве размерности 2М, а
изменение состояния системы во времени-движением точки вдоль линии, наз. фазовой
траекторией. Для статистич. описания состояния системы вводятся понятия фазового
объема (элемента объема фазового пространства) и ф-ции распределения f(p,
q), к-рая характеризует плотность вероятности нахождения точки, изображающей
состояние системы, в элементе фазового пространства вблизи точки с координатами
р, q. В 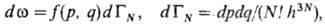
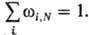
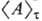 в момент времени т (т.е. по бесконечно
малому интервалу времени от т до т + dт)любой физ. величины
А(р, q), являющейся ф-цией координат и импульсов всех частиц
системы, с помощью ф-ции распределения вычисляется по правилу (в т.ч. и для
неравновесных процессов):
в момент времени т (т.е. по бесконечно
малому интервалу времени от т до т + dт)любой физ. величины
А(р, q), являющейся ф-цией координат и импульсов всех частиц
системы, с помощью ф-ции распределения вычисляется по правилу (в т.ч. и для
неравновесных процессов):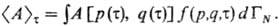
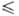 Ek
Ek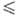 E + DE, и w(Ek) = 0, если Ek
< Е и Ek > E + DE. Величина
g(E, N, V)-т. наз. статистич. вес, равный числу
квантовых состояний в энергетич. слое DE. Важное соотношение С.
т.-связь энтропии системы со статистич. весом:
E + DE, и w(Ek) = 0, если Ek
< Е и Ek > E + DE. Величина
g(E, N, V)-т. наз. статистич. вес, равный числу
квантовых состояний в энергетич. слое DE. Важное соотношение С.
т.-связь энтропии системы со статистич. весом: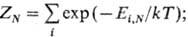
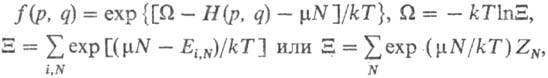
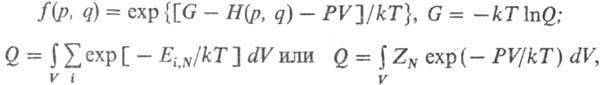
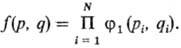
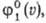 компоненты скоростей к-рых лежат в интервалах от ui до
ui + dui (i = x, у,
z), определяется ф-цией:
компоненты скоростей к-рых лежат в интервалах от ui до
ui + dui (i = x, у,
z), определяется ф-цией: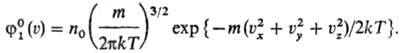
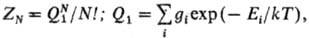
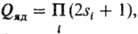
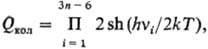 n-число атомов в молекуле. Сумму по состояниям вращат. движений многоатомной
молекулы с большими моментами инерции можно рассматривать классически [высокотемпературное
приближение, T/qi
n-число атомов в молекуле. Сумму по состояниям вращат. движений многоатомной
молекулы с большими моментами инерции можно рассматривать классически [высокотемпературное
приближение, T/qi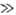 1,
где qi = h2/8p2kIi
(i = x, у, z), It-главный момент инерции вращения
вокруг оси i]: Qвр = (pT3/qxqyqz)1/2.
Для линейных молекул с моментом инерции I статистич. сумма Qвр
= T/q, где q = h2/8p2*kI.
1,
где qi = h2/8p2kIi
(i = x, у, z), It-главный момент инерции вращения
вокруг оси i]: Qвр = (pT3/qxqyqz)1/2.
Для линейных молекул с моментом инерции I статистич. сумма Qвр
= T/q, где q = h2/8p2*kI.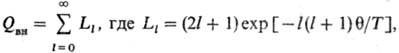
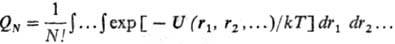
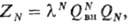
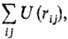 где
U(rij)- потенциал центр. сил, зависящий от расстояния
rij между молекулами i и j. Учитывают также
многочастичные вклады в потенц. энергию, эффекты ориентации молекул и т.д. Необходимость
расчета конфигурац. интеграла возникает при рассмотрении любых конденсир. фаз
и границ раздела фаз. Точное решение задачи мн. тел практически невозможно,
поэтому для расчета статистич. суммы и всех термодинамич. св-в, получаемых из
статистич. суммы дифференцированием по соответствующим параметрам, используют
разл. приближенные методы.
где
U(rij)- потенциал центр. сил, зависящий от расстояния
rij между молекулами i и j. Учитывают также
многочастичные вклады в потенц. энергию, эффекты ориентации молекул и т.д. Необходимость
расчета конфигурац. интеграла возникает при рассмотрении любых конденсир. фаз
и границ раздела фаз. Точное решение задачи мн. тел практически невозможно,
поэтому для расчета статистич. суммы и всех термодинамич. св-в, получаемых из
статистич. суммы дифференцированием по соответствующим параметрам, используют
разл. приближенные методы.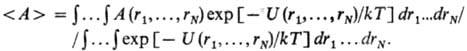
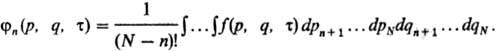
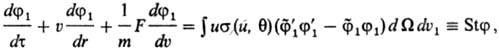
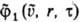 -ф-ции
распределения частиц до столкновения,
f1(u, r, т) и
-ф-ции
распределения частиц до столкновения,
f1(u, r, т) и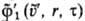 -ф-ции
распределения после
столкновения; u и
-ф-ции
распределения после
столкновения; u и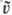 -скорости
частиц до столкновения, u и
-скорости
частиц до столкновения, u и 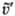 -скорости
тех же частиц после столкновения, и = |u —
-скорости
тех же частиц после столкновения, и = |u —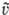 |-модуль
относит. скорости сталкивающихся частиц, q - угол между относит. скоростью
u —
|-модуль
относит. скорости сталкивающихся частиц, q - угол между относит. скоростью
u —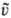 сталкивающихся частиц и линией, соединяющей их центры, s(u,q)dW-дифференц.
эффективное сечение рассеяния частиц на телесный угол dW в
лаб. системе координат, зависящее от закона взаимод. частиц. Для модели молекул
в виде упругих жестких сфер, имеющих радиус R, принимается s = 4R2cosq.
В рамках классич. механики дифференц. сечение выражается через параметры столкновения
b и e (соотв. прицельное расстояние и азимутальный угол линии центров):
sdW = bdbde, а молекулы рассматриваются
как центры сил с потенциалом, зависящим от расстояния. Для квантовых газов выражение
для дифференц. эффективного сечения получают на основе квантовой механики, с
учетом влияния эффектов симметрии на вероятность столкновения.
сталкивающихся частиц и линией, соединяющей их центры, s(u,q)dW-дифференц.
эффективное сечение рассеяния частиц на телесный угол dW в
лаб. системе координат, зависящее от закона взаимод. частиц. Для модели молекул
в виде упругих жестких сфер, имеющих радиус R, принимается s = 4R2cosq.
В рамках классич. механики дифференц. сечение выражается через параметры столкновения
b и e (соотв. прицельное расстояние и азимутальный угол линии центров):
sdW = bdbde, а молекулы рассматриваются
как центры сил с потенциалом, зависящим от расстояния. Для квантовых газов выражение
для дифференц. эффективного сечения получают на основе квантовой механики, с
учетом влияния эффектов симметрии на вероятность столкновения.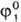 .
В простейшем (релаксационном) приближении интеграл столкновений аппроксимируется
как Stf = = -(f1 -
.
В простейшем (релаксационном) приближении интеграл столкновений аппроксимируется
как Stf = = -(f1 - 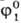 )/т*,
где т*-среднее время релаксации. Зная решение ур-ния Больцмана, можно определить
плотность числа частиц газа в точке r в момент времени т: n = = тf1(u, r, т)du и
др. средние значения величин, характеризующих состояние газа: средняя (по абс.
значениям) скорость молекул, средний квадрат их скорости и т.д., а через них
рассчитать гидродинамич. характеристики процессов переноса
энергии, импульса и числа частиц, к-рые могут в нем происходить.
)/т*,
где т*-среднее время релаксации. Зная решение ур-ния Больцмана, можно определить
плотность числа частиц газа в точке r в момент времени т: n = = тf1(u, r, т)du и
др. средние значения величин, характеризующих состояние газа: средняя (по абс.
значениям) скорость молекул, средний квадрат их скорости и т.д., а через них
рассчитать гидродинамич. характеристики процессов переноса
энергии, импульса и числа частиц, к-рые могут в нем происходить. 1),
гидродинамич. ур-ния неприменимы и необходимо решать кинетич. ур-ние Больцмана
с определенными граничными условиями на пов-сти. Эти условия определяются ф-цией
распределения молекул, рассеянных из-за взаимод. со стенкой.
1),
гидродинамич. ур-ния неприменимы и необходимо решать кинетич. ур-ние Больцмана
с определенными граничными условиями на пов-сти. Эти условия определяются ф-цией
распределения молекул, рассеянных из-за взаимод. со стенкой.