Химическая энциклопедия
"СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ"
Главная - Химическая энциклопедия - буква С - СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
,
взаимодействие между магн. моментами, связанными со спиновыми и орбитальными
моментами кол-ва движения электронов и ядер в квантовой системе - атоме, молекуле,
кристалле и т.п. С.-о.в. обусловливает вклад в энергию системы, к-рому отвечают
три слагаемых гамильтониана в ур-нии Шрёдингера . Первое слагаемое связано с
магн. полем, возникающим при перемещении электрона относительно ядра в электрич.
поле ядра и действующим на спиновый магн. момент; второе-с магн. полем, возникающим
при движении данного электрона в электрич. поле всех остальных электронов, третье-с
взаимод. спинового магн. момента данного электрона с магн. полями, создаваемыми
всеми остальными электронами при их движении. Для электронов i
и j с радиусами-векторами ri и rj и
импульсами (Моментами кол-ва движения) pi и pj
их С.-о. в. друг с другом и с ядрами а, заряды к-рых равны Za
(в единицах элементарного заряда е) и радиусы-векторы Ra,
приводит к дополнит. вкладу в гамильтониан системы, состоящему из след. трех
сумм: где ђ и mВ-постоянная
Планка и магнетон Бора соотв.; Ria = ri-Ra,
rij=ri — rj (rij-длина
вектора rij); Iia
= = (ri — Ra)x
pi - момент кол-ва движения i-го электрона
относительно начала системы координат на ядре a, рij
= =pi - pj, Iij
= rij x pi, si-оператор
спина i-го электрона. Из этих сумм, как правило,
осн. вклад в энергию системы дает первая, тогда как вторая и третья (их обычно
наз. "взаимодействия спин-другая орбиталь") дают значительно меньшие
вклады. Если ими пренебречь, оператор С.-о. в. сводится к следующему: где С.-о.в. приводит к расщеплению
вырожденных уровней мультиплета, что проявляется в атомных и мол. спектрах как
тонкая структура. Так, вследствие С.-о.в. низший возбужденный уровень атомов
щелочных металлов расщепляется на два: 2P1/2
и 2Р3/2, где индекс внизу указывает
квантовое число полного момента кол-ва движения электрона на внеш. оболочке
пр. Для Na (Z = 11, n = 3) это расщепление составляет 17,2см-1,
для К (Z=19, n = 4) 57,7 см -1, для Cs (Z =55, n = 6) 554,1 см -1. У атомов галогенов расщепление уровней для
np-электронов еще больше, а постоянные С.-о.в. таковы: для F 272 см -1,
для Сl 587 см -1, для I 5060 см -1. При достаточно
сильном С.-о.в. понятие мультиплетности термов вообще теряет смысл и рассматривается
лишь полный момент кол-ва движения электронов, а не спин и орбитальный момент
в отдельности. Запрет на квантовые переходы между уровнями с разной мультиплетностью
при наличии С.-о.в. снимается, что приводит, напр., к фосфоресценции - излучат.
переходу из состояний с временами жизни, обратно пропорциональными квадратам
матричных элементов оператора С.-о.в., и к ин-теркомбинац. конверсии (см. Люминесценция
,
Фотохимические реакции
). Поскольку время фосфоресценции зависит не
только непосредственно от времени жизни "фосфоресцирующего" состояния
рассматриваемых молекул, но и от среды, в к-рой они находятся, для учета этой
зависимости вводят представление о межмолекулярном С.-о.в. У двухатомных и линейных
многоатомных молекул соотношение С.-о.в. и др. взаимодействий, напр. спин-вращательного,
позволяет выделять разл. случаи связи спинов, орбитальных и др. моментов (см. Хунда случаи связи
), что дает возможность для каждого случая связи
проводить специфич. классификацию квантовых состояний молекулы. В выражении для HSO
не представлен член, отвечающий взаимод. ядерного магн. спинового момента
и орбитального момента электронов, Лит. см. при ст.
Спин
. Н. В. Степанов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
будет выглядеть так: Что такое СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
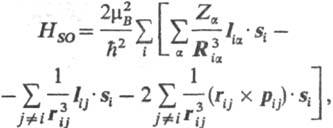
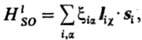
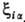 -
ф-ции координат электронов и ядер, а также зарядов ядер. Эти ф-ции пропорциональны
-
ф-ции координат электронов и ядер, а также зарядов ядер. Эти ф-ции пропорциональны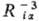 ,
поэтому при их усреднении
по всем возможным положениям электронов наиб. существенны те конфигурации системы,
при к-рых электроны находятся вблизи ядер. Если волновая ф-ция молекулы образована
из мол. орбиталей в форме линейной комбинации атомных орбиталей (см.
,
поэтому при их усреднении
по всем возможным положениям электронов наиб. существенны те конфигурации системы,
при к-рых электроны находятся вблизи ядер. Если волновая ф-ция молекулы образована
из мол. орбиталей в форме линейной комбинации атомных орбиталей (см. 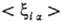 основной вклад дают интегралы
основной вклад дают интегралы
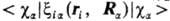 , вычисляемые
с атомными орбиталями
ca, центрированными на ядре a (см.
, вычисляемые
с атомными орбиталями
ca, центрированными на ядре a (см. 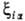 (ri,
Ra) для атомов заменяют на нек-рые постоянные, зависящие
от главного n и орбитального l квантовых чисел
(ri,
Ra) для атомов заменяют на нек-рые постоянные, зависящие
от главного n и орбитального l квантовых чисел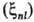 ;
их наз. постоянными С.-о.в. В
;
их наз. постоянными С.-о.в. В 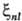 пропорциональна
Z4 и обратно пропорциональна n3. В
многоэлектронных атомах происходит экранирование ядра электронами и зависимость
постоянной С.-о.в. от Z и n становится не столь резко выраженной
и функционально более сложной. Тем не менее и в том и в другом случае С.-о.в.
наиб. велико для электронов внутр. оболочек тяжелых атомов, а у молекул-для
внутр. оболочек атомных остовов, что позволяет характеризовать
величины С.-о.в. и для молекул с помощью атомных постоянных
пропорциональна
Z4 и обратно пропорциональна n3. В
многоэлектронных атомах происходит экранирование ядра электронами и зависимость
постоянной С.-о.в. от Z и n становится не столь резко выраженной
и функционально более сложной. Тем не менее и в том и в другом случае С.-о.в.
наиб. велико для электронов внутр. оболочек тяжелых атомов, а у молекул-для
внутр. оболочек атомных остовов, что позволяет характеризовать
величины С.-о.в. и для молекул с помощью атомных постоянных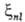
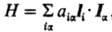 ,
где аia(Ria)
=
,
где аia(Ria)
=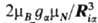 ,
ga-g-фактор ядра a, mN- ядерный магнетон,
Ia- ядерный спин. Связанное с этим членом расщепление
уровней заметно меньше, чем обусловленное С.-о.в.; напр., для электронного состояния
2Р1/2 атома Na величина aia
составляет 94,5 МГц, а для состояния 2Р3/2-19,1 МГц,
т.е. примерно 0,003-0,001 см-1. Обычно член Я выделяют (вместе с
др. членами того же порядка малости) в орбитальное сверхтонкое взаимодействие,
или сверхтонкое ядерное магн. взаимодействие, проявляющееся в спектрах ЭПР (см.
,
ga-g-фактор ядра a, mN- ядерный магнетон,
Ia- ядерный спин. Связанное с этим членом расщепление
уровней заметно меньше, чем обусловленное С.-о.в.; напр., для электронного состояния
2Р1/2 атома Na величина aia
составляет 94,5 МГц, а для состояния 2Р3/2-19,1 МГц,
т.е. примерно 0,003-0,001 см-1. Обычно член Я выделяют (вместе с
др. членами того же порядка малости) в орбитальное сверхтонкое взаимодействие,
или сверхтонкое ядерное магн. взаимодействие, проявляющееся в спектрах ЭПР (см.