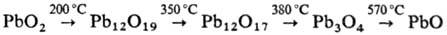Химическая энциклопедия
"СВИНЦА ОКСИДЫ"
Главная - Химическая энциклопедия - буква С - СВИНЦА ОКСИДЫ
СВИНЦА ОКСИДЫ
. В
системе Pb-О существуют оксиды: РbО2, Рb3О4,
РbО, Рb2О3, Рb12О17 и Рb12О19.
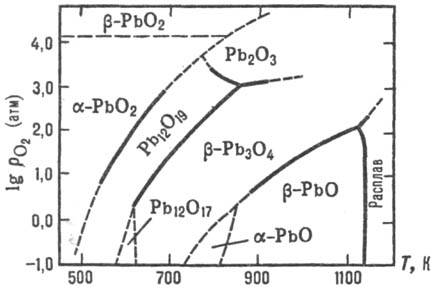
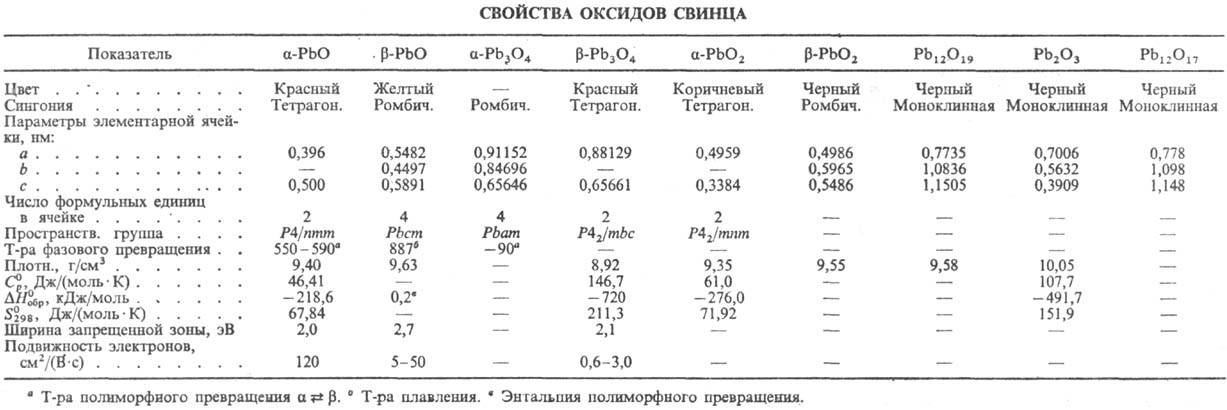
Области их существования приведены на рис. 1, св-ва-в таблице. Со., кроме РbО,
при нагр. в вакууме разлагаются до РbО с выделением О2.
Рис. 1. Диаграмма давление О2-т-ра системы Рb-О2.
Оксид РbО существует
в двух модификациях: низкотемпературной-a-РbО (минерал глет) и высокотемпературной-b-РbО
(минерал массикот). Их составы могут отклоняться от стехиометрических, границы
областей гомогенности
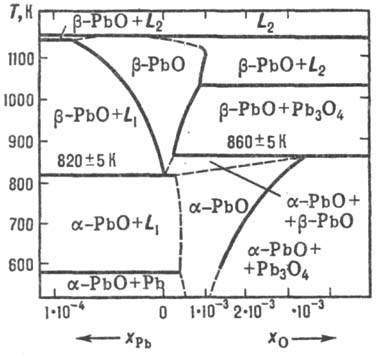
показаны на рис. 2. Полиморфный переход b : a протекает медленнее,
чем a : b, поэтому b-РbО может существовать при комнатной
т-ре в метастабильном состоянии, но при растирании переходит в a-PbO. Испаряется
РbО конгру-.энтно, в осн. в виде Рb2О2 и Рb4О4,
ур-ние температурной зависимости давления пара над твердым b-РbО: lgp
(Па) = 13,71-13,86·103/T(887-1151 К). Обладает полупроводниковыми
св-вами, в зависимости от состава (в пределах области гомогенности) имеет электронный
или дырочный тип проводимости, r резко падает при освещении. Рис. 2. Диаграмма Т-хi,
оксида РbО; хPb и х0- соотв. концентрация
избытка Рb и О2, в мол. долях; L1 L2-расплав. На воздухе при 540 °С
РbО окисляется до Рb3О4, при 330°С-до Рb12О19,
при 370°С-до Рb12О17, а в среде Н2 или
СО восстанавливается до металла. Р-римость (% по массе) в воде при 20°С:
a-РbО - 0,6·10 -3, b-PbО-1,2·10-3.
Хорошо раств. в HNО3 и р-ре НС1О4, хуже-в
соляной и серной к-тах из-за образования плохо р-римых РbС12 и PbSO4.
Раств. в р-рах щелочей, образуя гидроксоплюм-баты(II), напр. Na2[Pb(OH)4]. Получают РbО кипячением
Рb(ОН)2 в р-ре NaOH, причем при большом избытке щелочи получают a-PbO,
а при меньшем - b-РbО. При длит. кипячении происходит переход b:a.
b-РbО получают: термич. разложением РbСО3 или Pb(NO3)2,
окислением расплава Рb (650-700 °С) в потоке О2 или воздуха,
окислением паров свинецорг. соединений (так получают наиб. чистый продукт),
РbО применяют в произ-ве сурика, др. соединений Рb, свинцовых стекол (хрусталь,
флантглас) и глазурей, при росписи стекла и фарфора, при изготовлении олиф.
Его используют в качестве фоточув-ствит. материала в видиконах. Ортоплюмбат(IV) свинца(II)
(свинцовый сурик) Рb3О4 существует в двух модификациях:
низкотемпературной a и высокотемпературной b; на воздухе выше 570
°С разлагается до РbО; ур-ние температурной зависимости давления разложения
lgpO2 (Па) = 15,0-8,70· 103/T. В воде b-Рb3О4
плохо раств., хорошо раств. в расплавл. NaNO3, р-ре НСlO4;
при растворении в HNO3 образуется РbО2 и др. соединения.
Получают b-Рb3О4 прокаливанием мелкодисперсного порошка
b-РbО при 500 °С в потоке воздуха. Применяют как пигмент для антикоррозионных
красок и как замазку в свинцовых аккумуляторах. Диоксид РbО2
существует в двух модификациях; a-РbО2 разлагается на воздухе
при нагр. по схеме: РbО2 практически
не раств. в воде, раств. в р-рах щелочей с образованием гидроксоплюмбатов(IV),
напр. Nа2[Рb(ОН)6]; при сплавлении с основными оксидами
образует плюмоаты типа Na4PbO4; сильный окислитель: при
нагр. с H2SO4 реагирует с выделением О2, а
с соляной-С12, при растирании с S или красным P воспламеняется.
Получают РbО2 окислением Рb(ОСООСН3)2 хлорной
известью, электрохим. окислением солей Рb(II), разложением Рb3О4
в HNО3. Используют РbО2 в свинцовых аккумуляторах
и как окислитель (напр., как компонент головок спичек). Др. оксиды-Рb2О3
(сесквиоксид), Рb12О17, Рb12О19
по хим. св-вам близки к Рb3О4. Оксиды Рb12О17
и Рb12О19 получают термич. разложением РbО2
на воздухе или окислением свежеприготовленного РbО, а Рb2О3-гидротермальным
разложением РbО2 в р-ре NaOH при 250 °С или окислением РbО при
600°С и давлении О2 0,4 ГПа.
Лит.: Извозчиков В. А., Тимофеев О. А., Фотопроводящие оксиды свинца в электронике, Л., 1979, с. 7-35; Ковтуненко П. В., Хариф Я. Л., "Электронная промышленность", 1981, в. 7-8, с. 69-73; Куликов И. С., Термодинамика оксидов, М., 1986, с. 115-25. Я. Л. Хариф, П. В. Ковтуненко. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: СВИНЦА ОКСИДЫ
будет выглядеть так: Что такое СВИНЦА ОКСИДЫ