Химическая энциклопедия
"РУТЕНИЙ"
Главная - Химическая энциклопедия - буква Р - РУТЕНИЙ
РУТЕНИЙ
(от ср.-век.
лат. Ruthenia-Россия; ruthenium) Ru, хим. элемент VIII гр. периодич. системы,
ат. н. 44, ат. м. 101,07; относится к платиновым металлам. В природе
встречается семь стабильных изотопов: 96Ru (5,7%), 98Ru
(2,2%), 99Ru (12,8%), 100Ru (12,7%), 101Ru
(17,0%), 102Ru (31,3%), 104Ru (18,3%). Конфигурация внеш.
электронных оболочек атома 4d75s1. Наиб.
характерные степени окисления +3, +4, +6, +8; энергии ионизации Ru0
: Ru1+ : Ru2+ : Ru3+ соотв.
7,366, 16,763 и 28,46 эВ; атомный радиус 0,134нм, ионные радиусы (в скобках
указаны координац. числа) Ru3+ 0,082 нм (6), Ru4+ 0,076
нм (6), Ru5+ 0,071 нм (6), Ru7+ 0,052 нм (4), Ru8+
0,050 нм (4). Р.- редкий рассеянный элемент.
Содержание в земной коре 5-10 % по массе. Собств. минералы-лаурит (RuS2),
py-тенарсенид (RuAs)-очень редки. Вместе с др. платиновыми металлами Р. содержится
в рутениевом невьянските (Ir, Os, Ru), рутениевом сысертските (Os, Ir, Ru),
самородной платине, осрутине (Os, Ru), в виде изоморфной примеси-в пент-ландите,
пирротине, кубаните, халькопирите (в медно-никелевых месторождениях). Свойства. Р.-блестящий
серебристый металл. Кристал-лич. решетка гексагональная типа Mg, а = 0,27054
нм, с = 0,42825 нм, z = 2, пространств. группа P63/mmc;
т.пл. 2334 °С, т. кип. 4077 °С; плотн. 12,45 г/см3; По хим. св-вам Р.-типичный
представитель платиновых металлов. Стандартный электродный потенциал Ru2+
/Ru0 + 0,45 В. Р. проявляет все степени окисления от 0 до +8. Простые
соединения Р. обычно трудно получить в чистом виде. В р-рах существуют только
комплексные ионы. Компактный Р. не окисляется
на воздухе до 930 °С; не раств. в р-рах щелочей, а также в H2SO4,
HNO3, H3PO4, соляной, фтористоводородной и
уксусной к-тах, царской водке. Порошкообразный Р. при нагр. окисляется О2
до RuO2. Мелкодисперсный Р. (чернь) взрывает на воздухе самопроизвольно.
Губчатый Р. при нагр. медленно раств. в р-ре NaClO, в р-рах С12 в
соляной к-те, Вr-2 -в бромистово-дородной к-те, I2-
в этаноле; взаимод. с галогенами, S, Se, Те, поглощает Н2 с образованием
твердых р-ров. С N2 металлический Р. не взаимод., но комплексные
соединения Р. могут связывать азот воздуха, напр. [{Ru(NH3)5}2N2][BF4]4.
Р. сплавляется с большинством металлов. С переходными металлами образует твердые
р-ры и промежут. фазы структурного типа CsCl и Cr3Si, а также s-фазы
и фазы Лавеса (см. Интерметаллиды
). Р. переводят в р-р путем сплавления
его со смесью KNO3 и КОН, пероксидами Ва или Na при 530 °С с
послед. выщелачиванием плава, хлорированием смеси шихты Р. с КС1 при ~530 °С
и дальнейшим выщелачиванием разб. соляной к-той. Тетраоксид RuO4-золотисто-желтые
кристаллы; т.пл. 25,5 °С, т. кип. 27 °С, т. разл. 108 °С; плотн.
3,29 г/см3 (21 °С); DH0обр
-305,2 кДж/моль; р-римость в воде (г в 100 г): 2,033 (20 °С), 2,249 (74
°С); раств. в спиртах, ССl4; окислитель; взаимод. с разб. соляной
к-той, давая хлорорутенаты. Получают взаимод. K2RuO4 с
КОН и С12 либо K2RuO4 с КМnО4, или
КIO4 и H2SO4; промежут. продукт при получении
Р. при селективном выделении в аналит. химии; тетраоксид 105Ru извлекают
из продуктов деления U и Рu. Диоксид RuO2-темно-синие
кристаллы тетрагон. син-гонии (а = 4,4919 нм, с = 0,31066 нм,
пространств. группа Р42/тпт); т. разл. 730-750
°С; плотн. 6,97 г/см3; не раств. в воде, к-тах и щелочах при
кипячении; при 400 °С восстанавливается Н2 до металла; взаимод.
с оксидами (РbО, BaO,
SrO, Bi2O3), давая рутенаты(IV), обладающие ме-таллич.
типом проводимости, сам RuO2 также электро-проводен; при 298 К r
для RuO2 4·10-3Ом·м, SrRuO3 4·10-2Ом·м,
BaRuO3 6,5·10-2 Ом·м, Pb2Ru2O6
3,0·10-2 Ом·м, Bi2Ru2O7 4,7·10-1
Ом·м; получают прокаливанием выше 500 °С на воздухе Ru(OH)4,
(NH4)2[RuCl6], (NH4)2[Ru(NO)Cl5].
RuO2 и рутенаты-резисторные материалы в микроэлектронике. Гидр оксид
Ru(OH)4-черное аморфное в-во; получают восстановлением K2RuO4
этанолом, гидролитич. разложением солей Ru(IV); применяют в аналит. химии для
концентрирования Р. из р-ров, осаждения Р. при его произ-ве. Дисульфид RuS2-темно-зеленые
кристаллы кубич. син-гонии (z = 4, пространств. группа Ра3,
для минерала лаури-та а — 0,560 нм) или черное аморфное в-во; т.
разл. 1000°С; плотн. 6,99 г/см3; Пентафторид RuF5-темно-зеленые
кристаллы; т.пл. 85,4 °С, т. кип. 227 °С; гигроскопичен; гидролизуется
водой; получают взаимод. Ru с F2 при 300-450 °С. Трихлорид RuCl3-черные
или коричневые кристаллы, т.возг. 777 °С, т. разл. выше 500 °С; плотн.
3,11 г/см3; Рутенат(VI) калия K2RuO4-черно-зеленые
кристаллы; т. разл. 440 °С; раств. в воде и р-рах щелочей, в к-тах диспропорционирует
на Ru(IV) и Ru(VII); получают сплавлением Р. с КОН и KNO3 или К2О2;
промежут. продукт при аффинаже Р., используется также для приготовления катализаторов
на носителях. "Рутениевая красная
соль" [Ru3O2(NH3)14]Cl6·4H2O-красные
кристаллы; раств. в воде; получают длит. нагреванием р-ров соед. Ru(III) и NH3;
применяют для гис-тологич. исследований животных и растит. тканей, как краску
для фарфора. "Бурая соль" K4[Ru2OCl10]·H2O-бурые
кристаллы; раств. в воде, не раств. в орг. р-рителях; получают взаимод. RuO4
с р-ром КС1 в соляной к-те или восстановлением K2RuO4
в соляной к-те спиртом; промежут. продукт при получении солей Ru(IV), Ru(OH)4,
RuO2. Гексахлорорутенат(IV) аммония (NH4)2[RuCl6]-черные
кристаллы; т. разл. 360 °С; плохо раств. в воде, раств. в неорг. к-тах;
получают взаимод. RuO4 с насыщ. р-ром NH4C1 в конц. соляной
к-те; промежут. продукт при аффинаже Р., при получении RuO2. Аквапентахлорорутенат(III)
калия K2[Ru(H2O)Cl5]-темно-красные кристаллы;
т. разл. 180°С; раств. в воде и неорг. к-тах; получают кипячением K4[Ru2OCl10]
в смеси соляной к-ты и этанола; применяют при получении Р. и соед. Ru(III). Нитрозопентахлорорутенат(III)
аммония (NH4)2[Ru(NO)Cl5]-малиново-красные
кристаллы; т. разл. 320 °С; раств. в воде; получают взаимод. соед. Ru(III)
или Ru(IV) с царской водкой и послед. удалением HNO3 и осаждением
насыщ. водным р-ром NH4C1; промежут. продукт при получении RuO2
и нитрозокомплексов Ru(IV). Нитрозотринитрорутений(III) [Ru(NO)(NO3)3]·H2O-темно-вишневое
твердое гигроскопичное в-во; раств. в воде, к-тах, р-рах щелочей, орг. р-рителях;
получают взаимод. RuO4 с конц. HNO3 при нагр.; образуется
при переработке облученного ядерного топлива. Гидроксонитрозотетра-нитрорутенат(III)
натрия Na2[Ru(NO)(NO2)4(OH)]·2H2O-оранжевые
кристаллы; ок. 100°С обезвоживается, ок. 200 °С разлагается; раств.
в воде, ацетоне, этаноле; получают взаимод. соед. Ru(III) или Ru(IV) с насыщ.
водным р-ром NaNO2; применяют для нанесения рутениевых покрытий на
металлы, керамику. Пентакарбонил Ru(CO)5-летучая
жидкость; т.пл. — 22 °С; не раств. в воде, раств. в орг. р-рителях; получают
взаимод. RuI3 с СО при 170°С (4,4 МПа) в присут. Ag; применяют
для нанесения рутениевых покрытий из газовой фазы на металлы, стекло, керамику.
Ацетилацетонат Ru(CH3COCH2COCH3 )3
- кроваво-красные кристаллы; т.пл.
76,4 °С; не раств. в воде, раств. в орг. р-рителях; получают взаимод. RuCl3
с ацетилацетоном и К2СО3; применяют для нанесения рутениевых
покрытий из газовой фазы на металлы, стекло, кварц, керамику, для получения
рутеноцена. См. также Рутенийорганические соединения
. Получение. Остатки
после аффинажа шлиховой Pt или концентраты после переработки шламов электрорафинирования
черновых Си и Ni сплавляют с ВаО2 или Na2O2,
раств. в воде, на р-р действуют С12, отгоняют образовавшийся RuO4,
к-рый поглощают из газов соляной к-той; затем осаждают (NH4)2
[RuCl6], прокаливают его до RuO2 и восстанавливают в токе
Н2, получая рутениевый порошок 99,9%-ной чистоты. Выплавляют Р. и
его сплавы в индукц. печах (в тиглях из стабилизированного ZrO2 или
электро-плавленного магнезита) либо в дуговых печах в среде Аr или в вакууме. Значит. кол-ва радиоактивного
Р. предполагается извлекать из радиоактивных отходов, образующихся при работе
АЭС. Применение. Легирующие
добавки Р. значительно повышают прочность, твердость, термич. и коррозионную
стойкость сплавов. Р.- компонент сплавов с Pt и Rh (для фильер, используемых
в произ-ве стекловолокна и вискозы), с Ir, Os, W (для перьев авторучек), с Ir
(для высокотемпературных термопар, эксплуатируемых до 2000 °С), с Pt и Pd
(для изготовления износостойких деталей разл. измерит. приборов, электроконтактов,
ювелирных изделий). Р. и его сплавы с Pd, нанесенные в виде черней на носители,-катализаторы
гидрирования и дегидрирования орг. соединений. Р. используют также для нанесения
защитных покрытий на электрич. контакты. Радиоактивные 103Ru (T1/2
39,8 сут) и 106Ru (T1/2 1 ч)-изотопные индикаторы. Мировое произ-во Р. (без
СНГ) не превышает 10 т/год. Летучие и растворимые соединения
Р. вызывают аллергию, раздражают слизистые оболочки, могут вызывать их изъязвление.
ПДК в воздухе рабочей зоны для RuO2 1 мг/м3. Р. открыл К. К. Клаус в
1844. Лит.: Синицын Н.
М., в кн.: Благородные металлы я их заменители, Свердловск, 1971; Раевская М.
В., Соколовская Е. М., Физикохимия рутения и его сплавов, М., 1979; Seddon E.
А., Seddon K. R., The chemistry of ruthenium, Amst., 1984. H.M. Синицын. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: РУТЕНИЙ
будет выглядеть так: Что такое РУТЕНИЙ
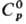 24,0 Дж/(моль·К);
24,0 Дж/(моль·К); 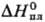 38,3 кДж/моль,
38,3 кДж/моль,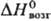 647,4 кДж/моль;
647,4 кДж/моль;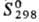 28,56
Дж/(моль · К); теплопроводность при 100 К монокристалла перпендикулярно оси
с 140Вт/(м·К), параллельно оси с 180Вт/(м·К), для поли-кристаллич.
150 Вт/(м · К); температурный коэф. линейного расширения для монокристалла перпендикулярно
оси с 5,8·10-6К-1 (300К), 7,95·10-6K-1
(1000 К). 13,02·10-6 К-1 (2000 К), параллельно оси с 8,7·10-6К-1 (300 К), 1,181·10-5K-1
(1000 К), 1,815·10-5 (2000 К); r при 273 К для монокристалла
перпендикулярно оси с 3,16·10-7 Ом·м, параллельно оси с 2,17·10-7 Ом·м, для поликристаллич. 2,83·10-7 Ом·м;
парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно
оси с + 4,15·10-5, параллельно оси с + 3,20·10-5,
для поликристаллич. 3,81·10-5; отражат. способность для электрополированного
монокристалла 71,1% (l = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404
мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич.
(99,8%-ной чистоты) +9,5·10-1 м3/Кл (100 К), + 7,0·10-11
м3/Кл (290 К), +4,5·10-1 м3/Кл (700 К), для
монокристалла при 293 К перпендикулярно оси с + 1,75·10-10
м3/Кл, параллельно оси с +1,11·10-10 м3/Кл.
Модуль Юнга 485,4 ГПа, sраст 172 ГПа, коэф. Пуассона 0,31; для
отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю
2000-3000 МПа, условный предел текучести при растяжении 350-400 МПа (остаточная
деформация 0,2%), 500-600 МПа (остаточная деформация 13%), относит. удлинение
3-10%, сужение 2-3%. Поликристаллический Р. с трудом поддается пластич. деформированию
выше 1500°С. Рафинированный зонной плавкой монокристаллический Р. пластичен
при комнатной т-ре.
28,56
Дж/(моль · К); теплопроводность при 100 К монокристалла перпендикулярно оси
с 140Вт/(м·К), параллельно оси с 180Вт/(м·К), для поли-кристаллич.
150 Вт/(м · К); температурный коэф. линейного расширения для монокристалла перпендикулярно
оси с 5,8·10-6К-1 (300К), 7,95·10-6K-1
(1000 К). 13,02·10-6 К-1 (2000 К), параллельно оси с 8,7·10-6К-1 (300 К), 1,181·10-5K-1
(1000 К), 1,815·10-5 (2000 К); r при 273 К для монокристалла
перпендикулярно оси с 3,16·10-7 Ом·м, параллельно оси с 2,17·10-7 Ом·м, для поликристаллич. 2,83·10-7 Ом·м;
парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно
оси с + 4,15·10-5, параллельно оси с + 3,20·10-5,
для поликристаллич. 3,81·10-5; отражат. способность для электрополированного
монокристалла 71,1% (l = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404
мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич.
(99,8%-ной чистоты) +9,5·10-1 м3/Кл (100 К), + 7,0·10-11
м3/Кл (290 К), +4,5·10-1 м3/Кл (700 К), для
монокристалла при 293 К перпендикулярно оси с + 1,75·10-10
м3/Кл, параллельно оси с +1,11·10-10 м3/Кл.
Модуль Юнга 485,4 ГПа, sраст 172 ГПа, коэф. Пуассона 0,31; для
отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю
2000-3000 МПа, условный предел текучести при растяжении 350-400 МПа (остаточная
деформация 0,2%), 500-600 МПа (остаточная деформация 13%), относит. удлинение
3-10%, сужение 2-3%. Поликристаллический Р. с трудом поддается пластич. деформированию
выше 1500°С. Рафинированный зонной плавкой монокристаллический Р. пластичен
при комнатной т-ре.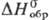 —197 кДж/моль; не взаимод. со щелочами
и кипящей H2SO4; образуется при взаимод. H2S
с р-рами солей Ru(IV); используется для выделения Р. из р-ров при его получении
в аналит. химии.
—197 кДж/моль; не взаимод. со щелочами
и кипящей H2SO4; образуется при взаимод. H2S
с р-рами солей Ru(IV); используется для выделения Р. из р-ров при его получении
в аналит. химии.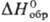 —205 кДж/моль; не раств. в воде, раств. в соляной к-те; получают взаимод. Ru
с С12 в присут. СО при 330 °С; применяют при получении рутениевой
черни и соед. Ru (карбонилов, рутеноцена и др.).
—205 кДж/моль; не раств. в воде, раств. в соляной к-те; получают взаимод. Ru
с С12 в присут. СО при 330 °С; применяют при получении рутениевой
черни и соед. Ru (карбонилов, рутеноцена и др.).