Химическая энциклопедия
"РТУТЬ"
Главная - Химическая энциклопедия - буква Р - РТУТЬ
РТУТЬ
(Hydrargyrum),
Hg, хим. элемент II гр. периодич. системы, ат.н. 80, ат.м. 200,59. Природная
Р. состоит из семи стабильных изотопов: 196Hg (0,146%), 198Hg
(10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg
(13,22%), 202Hg (29,80%), 204Hg (6,85%). Поперечное сечение
захвата тепловых нейтронов для прир. смеси изотопов 38·10-27м2.
Конфигурация внеш. электронных оболочек атома 5s25p65d10
6s2;
степень окисления + 1 и + 2; энергии ионизации Hg0:Hg+:Hg2+:Hg3+
соотв. 10,4376, 18,756 и 34,2 эВ; сродство к. электрону —0,19 эВ; работа выхода
электрона 4,52 эВ; электроотрицательность по Полингу 1,9; атомный радиус 0,155
нм, ковалентный радиус 0,149 нм, ионный радиус (в скобках указано координац.
число) Hg+ 0,111 нм (3), 0,133 нм (6), Hg2+ 0,083 нм (2),
0,110 нм (4), 0,116 нм (6), 0,128нм (8). Содержание R в земной коре
7,0·10-6% по массе, в морской воде (1,03 мг/м3, в атмосфере
2·10-3мг/м3. Р. относят к рассеянным элементам (в конц.
виде в месторождениях находится только 0,02% всей Р.); в природе встречается
в своб. состоянии. Образует более 30 минералов. Осн. рудный минерал - киноварь
HgS. Минералы Р. в виде изоморфных примесей встречаются в кварце, халцедоне,
карбонатах, слюдах, свинцово-цинковых рудах. В обменных процессах гидросферы,
литосферы, атмосферы участвует большое кол-во Р. Запасы Р. (без СНГ) -500
тыс. т, в т.ч. в Испании-250, Италии-100, США-50, Канаде-15, Мексике-15, Турции-9,
Алжире-8; значит. ресурсами обладают Япония, Боливия, Перу, КНР, Словакия. Содержание
Р. в рудах от 0,05 до 6-7%. Свойства. Р.-серебристо-белый
металл, в парах бесцв.; единств. из металлов-жидкий при комнатной т-ре; т.пл.
- 38,87 °С, т. кип. 356,58 °С; плотн. (г/см3): 13,5951 (0°С),
13,5457 (20°С), 13,5336 (25°С), 13,4118 (75°С), 13,3515 (100 °С); Твердая Р.-бесцв. кристаллы;
до 79 К существует ромбоэдрич. кристаллич. модификация a (при 78 К: а = 0,29925 нм, b = 70,74°). Ниже 79 К существует b-Hg с тетрагон.
объемноцентрир. решеткой (а = 0,3995 нм, с = 0,2825 нм); плотн.
твердой Р. 14,193 г/см3 (-38,9°С). Р-римость Р. (г в 100 г):
в воде 6·10-6 (25°С), бензоле 2·10-7 (20 °С),
диоксане 7,0·10-7 (25 °С). Ртуть не смачивает стекло. Стандартный электродный
потенциал Р.: для Hg22+/Hg0 + 0,789
В; Hg2+/Hg0 + 0,854 В; Hg2 +/Hg22+
+ 0,920 В. Кислород и сухой воздух не окисляют Р. при обычной т-ре, однако при
УФ облучении или электронной бомбардировке окисление Р. значительно ускоряется.
Во влажном воздухе Р. покрывается пленкой оксидов. Р. окисляется выше 300 °С
кислородом и при комнатной т-ре озоном до ртути оксида
HgO. Р. не реагирует при нормальных
условиях с Н2, но с атомарным H образует газообразный гидрид
HgH [для газа: Р. образует сплавы - амальгамы
со мн. металлами. Стойкие к амальгамированию металлы-V, Fe, Mo, Cs, Nb,
Та, W. Co мн. металлами Р. дает интерметаллич. соед., наз. меркуридами.
Об орг. соединениях Р. см. Ртутьорганические соединения
. Р. образует два ряда солей-Hg(I)
и Hg(II). Соли Hg(I) существуют в виде димеров, группировка —Hg—Hg— сохраняется
как в твердом состоянии, так и в р-ре, причем катион Hg22+
стоек в водном р-ре. Мн. соединения Р. летучи, разлагаются на свету, при натр.,
легко восстанавливаются даже слабыми агентами, напр. аминами, кетонами, альдегидами. Амидохлорид ртути(II) Hg(NH2)Cl-неплавкое
бесцв. в-во-преципитат; плотн. 5,70 г/см3; плохо раств. в воде (0,14
г в 100 г при 18 °С); получают взаимод. HgCl2 с NH3;
антисептик, компонент лек. ср-в и косметич. препаратов. Азид ртути(II) Hg (N3)2
- бесцв. кристаллы; Нитрат ртути(I) Hg2(NO3)2-бесцв.
кристаллы; разлагается водой, раств. в CS2, HNO3; образует
кристаллогидрат Hg2(NO3)2·2H2O (т.пл.
70 °С, плотн. 4,79 при 4°С), теряющий воду на воздухе; р-ры- сильные
восстановители; получают взаимод. Hg с HNO3 ниже 45 °С; применяют
в меркуриметрич. методе объемного анализа, для чернения латуни, как компонент
глазурей, пиротехн. составов. Нитрат ртути(II) Hg(NO3)2-бесцв.
кристаллы; водой гидролизуется; образует кристаллогидраты с 0,5 (т. пл. 79 °С,
плотн. 4,39 г/см3) и одной (плотн. 4,3 г/см3) молекулами
воды; получают взаимод. Hg с горячей конц. HNO3; применяют в меркуриметрич.
методе объемного анализа, для нитрования ароматич. соединений. Сульфат ртути(I) Hg2SO4-бесцв.
кристаллы с моноклинной решеткой; плотн. 7,56 г/см3 Тиоцианат (роданид) ртути(II)
Hg(SCN2)-бесцв. кристаллы; Получение. Р. получают
гл. обр. пирометаллургически-окислит.-восстановит. обжигом руд или концентратов
при 700-800 °С в печах кипящего слоя, трубчатых, муфельных и др. При обжиге
Р., находящаяся в осн. в руде в виде киновари, восстанавливается до металла
(HgS + О2 : Hg + SO2);
в парообразном состоянии она удаляется из зоны р-ции с отходящими газами, очищается
в электрофильтрах от взвешенных частиц пыли и конденсируется в спец. конденсаторах.
Выход Р. более 80%. Перспективны вакуумный обжиг ртутьсодержащего сырья и гидрометаллургич.
извлечение Р. выщелачиванием HgS водными щелочными р-рами Na2S или
Na2Sn (n = 2 — 4). Образовавшиеся р-ры тиосолей
Р. подвергают электролизу или цементации Al, Zn, Sb. Для получения технической
Р. конденсированный в пирометал-лургич. процессе металл фильтруют через пористые
перегородки, керамич. фильтры, сукно, замшу и др., последовательно промывают
р-рами щелочей, азотной к-той, р-рами Hg(NO3)2 и перегоняют.
Для получения особо чистой Р. используют четырехстадийное электрохим. рафинирование
в электролизерах с ртутными электродами. Сумма 24 примесей по данным
хим.-спектрального и нейтронно-активац. анализа в особо чистой Р. составляет
1·10-6-3,3·10-7%. Определение. Качественно
Р. обнаруживают в виде Hg2NH2Cl, HgS, а также атомно-абсорбционным,
эмиссионным спектральным, фотометрич. и др. методами. Гравиметрически Р. определяют
в виде металла, HgS, Hg2Cl2, периодата Hg5(IO6)2.
Пробу руды разлагают при нагр., Р. отгоняется в присут. восстановителя (порошок
Fe или Си) под "шубой" из ZnO. Образующуюся Р. собирают на холодной
золотой пластинке, к-рую по окончании анализа промывают и взвешивают. При низком
содержании Р. в рудах используют кислотное разложение руд с добавлением фторида
для растворения кварца и силикатов, содержащих Р. в высокодисперсном состоянии;
затем проводят концентрирование путем отделения примесей др. элементов экстракцией
разл. комплексных соединений Р. (галогенидов, рода-нидов, дитиокарбаматов и
др.). При прокаливании и сплав-ледии рудных концентратов и соединений Р. с содой
Р. полностью удаляется в виде металла. Для подготовки ана-лит. пробы используют
сочетание экстракции с термич. восстановлением и отгонкой Р.; подготовленную
пробу можно анализировать любым из перечисленных выше методов. Термич. восстановление
используют также для качеств. обнаружения Р. даже при низких ее концентрациях.
При фотометрич. определении Р. в качестве реактива используют 1-(2-пиридилазо)-2-нафтол,
позволяющий определять микрограммовые кол-ва. Следы Р. также м. б. определены
при помощи дитизона, используемого как при фотометрич., так и при титриметрич.
определении. Р. в воздухе лаб. и производств.
помещений количественно определяют с помощью атомно-абсорбц. спектрофотометров,
предел обнаружения в воздухе до 10-8 г/м3. Для качеств.
и количеств. определений Р. в воздухе используют разл. хим. индикаторы паров
P. (KI, I2, Cul, SeS, Se, AuBr3, AuCl3 и др.),
к-рые наносят на силикагель, фильтров. бумагу и др. материалы. Применение. Р. используют
для изготовления катодов при электрохим. получении едких щелочей и хлора, а
также для полярографов; в произ-ве ртутных вентилей, газоразрядных источников
света (люминесцентных и ртутных ламп), диффузионных вакуумных насосов, контрольно-измерит.
приборов (термометров, барометров, манометров и др.); для определения чистоты
фтора, а также его концентрации в газах. Мировое произ-во Р. в последнее
десятилетие составляло ок. 8600 т/год. Потребление Р. (т/год): в США-1800-2000,
Японии-600-900, ФРГ-600, Италии-550, Испании-400, Великобритании-350, Франции-300. Техника безопасности.
Металлическая Р. высоко токсична для любых форм жизни. Пары и соед. Р. чрезвычайно
ядовиты, накапливаются в организме, легко сорбируются легочной тканью, попадают
в кровь, подвергаются ферментативному окислению до ионов Р., к-рые образуют
соед. с молекулами белка, многочисл. ферментами, нарушают обмен в-в, поражают
нервную систему. Осн. мера предосторожности при работе с Р. и ее соед.-исключение
попадания Р. в организм через дыхат. пути или пов-сть кожи. ПДК Р. в
воздухе рабочей зоны 0,01 мг/м3, в атм. воздухе 0,0003 мг/м3,
в воде водоемов 0,0005 мг/л, в почве 2,1 мг/кг (класс опасности 1). Естеств.
источники загрязнения среды-испарение со всей пов-сти суши, возгонка из соед.,
находящихся глубоко в толще земной коры, вулканич. деятельность; в результате
жизнедеятельности человека-металлургия, сжигание орг. топлив, произ-во хлора
и соды, бытовые (сжигание мусора, сточные воды и т.д.) и др. Экологич. последствия
проявляются прежде всего в водной среде-подавляется жизнедеятельность одноклеточных
морских водорослей и рыб, нарушается фотосинтез, ассимилируются нитраты, фосфаты,
соед. аммония и т. д. Пары Р. фитотоксичны, ускоряют старение растений. Ртуть известна с доисторических
времен в Китае, Индии, Египте и др. Лит.: Козин Л. Ф.,
Физико-химические основы амальгамной металлургии, А,-А., 1964; Мельников С.
М., Металлургия ртути, М., 1971; Пугаче-вич П. П., Работа со ртутью в лабораторных
и производственных условиях, М., 1972; Мельников С. М., Техника безопасности
в металлургии ртути, М., 1974; Козин Л. Ф. [и др.], в сб.: Кинетика и механизм
электрохимических реакций, А.-А., 1977; Упор Э., Мохаи М., Новак Д., Фотометрические
методы определения следов неорганических соединений, пер. с англ., М., 1985;
Трахтенберг Т.М., Коршун М. H., Ртуть и ее соединения в окружающей
среде, К., 1990. . Л.Ф. Козин.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: РТУТЬ
будет выглядеть так: Что такое РТУТЬ
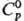 27,98
ДжДмоль·К);
27,98
ДжДмоль·К);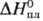 2,295
кДж/моль,
2,295
кДж/моль, 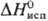 61,88
кДж/моль;
61,88
кДж/моль; 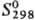 75,90
ДжДмоль- К); tкрит 1677 °С, pкрит
74,2 МПа, dкрит 3,56 г/см3; ур-ние температурной
зависимости давления пара: lgp (мм рт.ст.) =-53,700 x x 0,05223/T+
7,752 (273-1573 К); теплопроводность [Вт/(см·К)]: 0,0782 (273,2 К), 0,0830 (298,2
К), 0,0947 (373,2 К); сжимаемость 39,5·10-6 МПа-1; температурный
коэф. объемного расширения 18,149·10-5 К-1 (273 К), 18,169·10-5
К-1 (298 К), 18,245·10-5 К-1 (373 К), температурный
коэф. линейного расширения 41·10-6К-1 (195-234 К); r
95,8·10-6 Ом·см (20 °С), температурный коэф. r 0,92·10-3
К-1 (273 К); диамагнетик, уд. магн. восприимчивость — 78,3·10-6;
т-ра перехода в сверхпроводящее состояние a-Hg 4,153 К, b-Hg 3,949
К; h 1,554 мПа·с (293 К), ур-ние температурной зависимости h = 0,560541
x x е-E/RT мПа·с, где E-2483,137 Дж/моль,
R-газовая постоянная, е-абс. коэф. термоэдс, в В/К; g 471,6
мН/м (293 К), ур-ние температурной зависимости g = 491,4985 + + 0,029385T
-0,00033185T2 мН/м; абс. коэф. тэрмоэдс -3,4мкВ/К (298 К),
для Р. в паре с медью 7,2 мкВ/К (298 К); коэф. Пельтье для спая железо-ртуть
(в мДж/К) 6,9 (291,4 К), 5,8 (372,6 К) и 6,32 (455,3 К); постоянная Холла при
293 К и магн. индукции 1,0-1,24Тл составляет (7,46-7,6)·10-10 м3/Кл.
75,90
ДжДмоль- К); tкрит 1677 °С, pкрит
74,2 МПа, dкрит 3,56 г/см3; ур-ние температурной
зависимости давления пара: lgp (мм рт.ст.) =-53,700 x x 0,05223/T+
7,752 (273-1573 К); теплопроводность [Вт/(см·К)]: 0,0782 (273,2 К), 0,0830 (298,2
К), 0,0947 (373,2 К); сжимаемость 39,5·10-6 МПа-1; температурный
коэф. объемного расширения 18,149·10-5 К-1 (273 К), 18,169·10-5
К-1 (298 К), 18,245·10-5 К-1 (373 К), температурный
коэф. линейного расширения 41·10-6К-1 (195-234 К); r
95,8·10-6 Ом·см (20 °С), температурный коэф. r 0,92·10-3
К-1 (273 К); диамагнетик, уд. магн. восприимчивость — 78,3·10-6;
т-ра перехода в сверхпроводящее состояние a-Hg 4,153 К, b-Hg 3,949
К; h 1,554 мПа·с (293 К), ур-ние температурной зависимости h = 0,560541
x x е-E/RT мПа·с, где E-2483,137 Дж/моль,
R-газовая постоянная, е-абс. коэф. термоэдс, в В/К; g 471,6
мН/м (293 К), ур-ние температурной зависимости g = 491,4985 + + 0,029385T
-0,00033185T2 мН/м; абс. коэф. тэрмоэдс -3,4мкВ/К (298 К),
для Р. в паре с медью 7,2 мкВ/К (298 К); коэф. Пельтье для спая железо-ртуть
(в мДж/К) 6,9 (291,4 К), 5,8 (372,6 К) и 6,32 (455,3 К); постоянная Холла при
293 К и магн. индукции 1,0-1,24Тл составляет (7,46-7,6)·10-10 м3/Кл.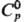 30,1 Дж/(моль·К);
30,1 Дж/(моль·К); 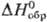 239,8 кДж/моль,
239,8 кДж/моль, 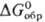 216,4 кДж/моль;
216,4 кДж/моль;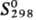 219,7
Дж/(моль·К)]. Гидрид HgH2 (т. разл. —125 °С) получают р-цией
HgI2 с Li [AlH4] в диэтиловом эфире. Р. не реагирует с
сухими НСl, HF, H2S, NH3, PH3 и AsH3
ниже 200 °С; с НВr, HI, H2Se, тонкоизмельченной S взаимод. уже
при 18-25 °С. Межгалогенные соед. BrCl, ICl, IBr, галогениды серы S2Cl2,
S2Br2, нитрозилхлорид реагируют с Р. при нагр. с образованием
соед. Hg(II). P. не взаимод. с N2, P, As, С, Si, В, Ge.
Не раств. в разб. серной и соляной к-тах, раств. в царской водке, HNO3
и горячей конц. H2SO4. С галогенами Р. активно взаимод.,
образуя
219,7
Дж/(моль·К)]. Гидрид HgH2 (т. разл. —125 °С) получают р-цией
HgI2 с Li [AlH4] в диэтиловом эфире. Р. не реагирует с
сухими НСl, HF, H2S, NH3, PH3 и AsH3
ниже 200 °С; с НВr, HI, H2Se, тонкоизмельченной S взаимод. уже
при 18-25 °С. Межгалогенные соед. BrCl, ICl, IBr, галогениды серы S2Cl2,
S2Br2, нитрозилхлорид реагируют с Р. при нагр. с образованием
соед. Hg(II). P. не взаимод. с N2, P, As, С, Si, В, Ge.
Не раств. в разб. серной и соляной к-тах, раств. в царской водке, HNO3
и горячей конц. H2SO4. С галогенами Р. активно взаимод.,
образуя 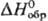 596,6 кДж/моль; взрывается при ударе; получают р-цией HgO с NH3 или
HgCl2 с NaN3; инициирующее ВВ. Ацетат ртути (II) Hg(OCOCH3)2
разлагается при нагр. и на свету; р-римость в воде (г в 100 г): 25 (10 °С),
100 (100 °С); раств. в этаноле, СН3СООН; получают взаимод. СН3СООН
с HgO при 60 °С; катализатор орг. р-ций, меркурирующий (от англ. назв. ртути-mercury)
агент, антисептик в медицине, реагент для определения
596,6 кДж/моль; взрывается при ударе; получают р-цией HgO с NH3 или
HgCl2 с NaN3; инициирующее ВВ. Ацетат ртути (II) Hg(OCOCH3)2
разлагается при нагр. и на свету; р-римость в воде (г в 100 г): 25 (10 °С),
100 (100 °С); раств. в этаноле, СН3СООН; получают взаимод. СН3СООН
с HgO при 60 °С; катализатор орг. р-ций, меркурирующий (от англ. назв. ртути-mercury)
агент, антисептик в медицине, реагент для определения 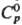 131,96 Дж/(моль· К);
131,96 Дж/(моль· К); 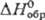 -744,65 кДж/моль,
-744,65 кДж/моль,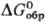 -627,45 кДж/моль;
-627,45 кДж/моль;
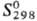 200,71 Дж/(моль·К);
р-римость в воде (г
в 100 г): 0,06 (25 °С), 0,09 (100 °С); горячей водой гидролизуется;
раств. в HNO3, H2SO4; получают осаждением из
р-ра Hg2(NO3)2 разб. H2SO4,
анодным растворением Hg в H2SO4; катализатор в орг. синтезе
(напр., при получении фталевого ангидрида из нафталина), материал для изготовления
нормальных элементов Кларка и Вестона, реагент при определении азота по Кьельдалю.
Сульфат ртути(II) HgSO4-бесцв. кристаллы с ромбич. решеткой; плотн.
6,47 г/см3; раств. в к-тах и р-рах NaCl, не раств. в орг. р-рителях,
NH3; гидролизуется водой; получают взаимод. Hg или HgO с конц. H2SO4;
катализатор при получении ацетальдегида из ацетилена, компонент электролита
в хим. источниках тока.
200,71 Дж/(моль·К);
р-римость в воде (г
в 100 г): 0,06 (25 °С), 0,09 (100 °С); горячей водой гидролизуется;
раств. в HNO3, H2SO4; получают осаждением из
р-ра Hg2(NO3)2 разб. H2SO4,
анодным растворением Hg в H2SO4; катализатор в орг. синтезе
(напр., при получении фталевого ангидрида из нафталина), материал для изготовления
нормальных элементов Кларка и Вестона, реагент при определении азота по Кьельдалю.
Сульфат ртути(II) HgSO4-бесцв. кристаллы с ромбич. решеткой; плотн.
6,47 г/см3; раств. в к-тах и р-рах NaCl, не раств. в орг. р-рителях,
NH3; гидролизуется водой; получают взаимод. Hg или HgO с конц. H2SO4;
катализатор при получении ацетальдегида из ацетилена, компонент электролита
в хим. источниках тока.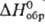 231,6 кДж/молъ; т. разл. 165°С; раств. в
горячей воде, плохо-в холодной (0,07 г в 100 г при 25 °С); раств. в р-рах
солей NH4 и KCN, в соляной к-те. При поджигании спрессованного роданида
Р. начинается р-ция 2Hg(SCN)2 : 2HgS + C3N4
+ CS2, инициирующая дальнейшее разложение соли; продукты р-ции HgS
и C3N4 выделяются в виде спека причудливой формы (т. наз.
фараоновы змеи). Получают Hg (SCN)2 взаимод. р-ра HSCN с солями Hg(II);
реагент для определения галогенидов, цианидов, сульфидов, тиосульфатов. См. также
231,6 кДж/молъ; т. разл. 165°С; раств. в
горячей воде, плохо-в холодной (0,07 г в 100 г при 25 °С); раств. в р-рах
солей NH4 и KCN, в соляной к-те. При поджигании спрессованного роданида
Р. начинается р-ция 2Hg(SCN)2 : 2HgS + C3N4
+ CS2, инициирующая дальнейшее разложение соли; продукты р-ции HgS
и C3N4 выделяются в виде спека причудливой формы (т. наз.
фараоновы змеи). Получают Hg (SCN)2 взаимод. р-ра HSCN с солями Hg(II);
реагент для определения галогенидов, цианидов, сульфидов, тиосульфатов. См. также