Химическая энциклопедия
"ПРАЗЕОДИМ"
Главная - Химическая энциклопедия - буква П - ПРАЗЕОДИМ
ПРАЗЕОДИМ
(от греч.
prasios- светло-зеленый и didymos двойник; лат. Praseodimium) Рг, хим. элемент
III гр. перио-дич, системы; относится к редкоземельным элементам (церие-вая
подгруппа лантаноидов); ат. н. 59, ат. м. 140,9077 В природе-единств. стабильный
изотоп 141Рr. Конфигурация внеш. электронных
оболочек атома 4f35s25р66s2;
степени окисления +4, +3, реже +2: энергии ионизации при последоват. переходе
от Рr0 к Рr4+ соотв. 5,42, 10,55, 21,624, 38,98 эВ; атомный
радиус 0,182 нм, ионный радиус (в скобках указано координац. число) Рr3+
0,113нм (6), 0,127нм (8), 0,132 (9), Рr4+ 0,099 нм (6), 0,110
(8). Содержание П. в земной
коре 7·10-4% по массе, в морской воде 2,6·10-6 мг/л. Вместе
с др. РЗЭ цериевой подгруппы содержится в минералах монаците и бастнезите (содержание
до 8%), лопарите, самарските, апатите. Свойства. П.-металл светло-серого
цвета; до 796 °С существует a-модификация с гексаген. решеткой типа
La, а = 0,36725 нм, с = 1,18354 нм, z = 4, пространств.
группа Р63/ттс; высокотемпературная b-модификация-кубич.
типа Си, а = 0,413 нм, z = 4, пространств. группа Fт3т;
DH0 перехода a На воздухе П. медленно
окисляется, при нагр., особенно в тонкодисперсном состоянии, возгорается. С
минер. к-тами бурно реагирует, слабо взаимод. с кипящей водой. Легко реагирует
с галогенами, N2, Н2, особенно при нагревании. Соед. Pr(IV)
с кислородом окрашены в черный цвет, фториды бесцв.; соед. Pr(III) имеют зеленую
окраску. В водных средах Рr4+ существует лишь в составе малоустойчивых
гетерополисоединений, твердые PrF4 и комплексные фториды Pr(IV) существенно
стабильнее, но нек-рые (напр., PrF4, Na2[PrF6])
при нагр. выделяют фтор. Соед. Рr(III) в водных средах весьма устойчивы, трудно
окисляются и не восстанавливаются.
Соед. Pr(II) известны лишь в твердой фазе (напр., низшие галогениды). Наиб. устойчив при обычных
условиях оксид состава Рr6О11, не являющийся, однако,
индивидуальным соединением. Его получают прокаливанием любых производных на
воздухе при 800-1000 °С. Сесквиоксид Рr2О3
получают прокаливанием Рr6О11 в восстановит. атмосфере
(Н2, СН4 и др.) или окислением металла при низкой т-ре.
Диоксид РrО2 образуется выше 300 °С при давлениях
О2 более 10 МПа. Все известные оксиды П. взаимод. с минер. и орг.
к-тами, давая водные р-ры солей Рr(III). Трифторид PrF3-бледно-зеленые
кристаллы с три-гон. решеткой (пространств. группа Р3С1, z = 6; для гек-сагон. установки: а = 0,7078 нм, с = 0,7239 нм);
т. пл. 1395°С, т. кип. 2300 °С; Три хлорид РrС13-зеленые
весьма гигроскопичные кристаллы с гексагон. решеткой (а = 0,7410 нм,
с = 0,4250 нм, z = 2, пространств. группа С63/m);
т, пл. 786 °С, т. кип. 1710 °С; Получение. При экстракционном
и хроматографич. разделении и дробной кристаллизации П. концентрируется вместе
с легкими лантаноидами и выделяется вначале в форме "дидима" - смеси
соед. Pr(III) и Nd(III), к-рые затем разделяют. Металлический П. получают из
безводных гало-генидов металлотермически или электролизом (осн. кол-во П.).
Электролитич. ванна содержит смеси безводных хлоридов Рr, Na и К; т-ра 800-850
°С; катод из графита, катодная плотн. тока 4 А/см2. Применение. П.-компонент
мишметалла, магн. сплавов с Со и Ni, легирующая добавка к стали и др. сплавам.
Оксиды П.-компоненты спец. стекол для защиты глаз от желтого излучения Na, а
также УФ и ИК излучения при сварке, обесцвечивают железосодержащие стекла, пигменты
для цветного стекла, художеств. керамики. Смеси оксидов Рr(III) и Ce(IV) - основа
полиритов (полирующие порошки) для оптич. линз, компоненты катализаторов крекинга. П. открыт в составе дидима
К. Ауэром фон Вельсбахом в 1885. Лит. см. при ст Редкоземельные элементы
. Л.
И Мартыненко, С Д Моисеев. Ю М Киселев |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ПРАЗЕОДИМ
будет выглядеть так: Что такое ПРАЗЕОДИМ
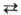 b
3,2 кДж/моль; при давлении 4 ГПа образуется модификация с кубич. решеткой типа
a-Fe, a = = 0,488 нм, z = 2, пространств. группа Fm3m;
т. пл. 932 °С, т. кип. 3512 °С; плотн. a-Рr 6,475 г/см3;
b-Рr 6,64 г/см3;
b
3,2 кДж/моль; при давлении 4 ГПа образуется модификация с кубич. решеткой типа
a-Fe, a = = 0,488 нм, z = 2, пространств. группа Fm3m;
т. пл. 932 °С, т. кип. 3512 °С; плотн. a-Рr 6,475 г/см3;
b-Рr 6,64 г/см3; 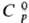 27,44 ДжДмоль·К);
27,44 ДжДмоль·К); 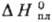 6,90 кДж/моль,
6,90 кДж/моль,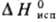 337,9 кДж/моль;
337,9 кДж/моль; 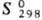 73,93 Дж/(моль·К); давление пара при
932 °С 2,47·10-5 Па; температурный коэф. линейного расширения
6,5·10-6 К-1; r 7,05·10-5 Ом·см (300 К);
парамагнетик, магн. восприимчивость +5,01·10~3 (20 °С); твердость
по Бринеллю 350-500 МПа. Легко поддается мех. обработке (в инертной атмосфере).
73,93 Дж/(моль·К); давление пара при
932 °С 2,47·10-5 Па; температурный коэф. линейного расширения
6,5·10-6 К-1; r 7,05·10-5 Ом·см (300 К);
парамагнетик, магн. восприимчивость +5,01·10~3 (20 °С); твердость
по Бринеллю 350-500 МПа. Легко поддается мех. обработке (в инертной атмосфере).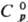 103,34 ДжДмоль·К);
103,34 ДжДмоль·К);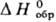 — 1689,1 кДж/моль;
— 1689,1 кДж/моль;
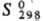 116,3 ДжДмоль-К);
получают взаимод. Рr6О11 с газообразным HF при 600 °С,
разложением фтораммониевых комплексов при 400-500 °С в атмосфере N2,
Аr и др.; применяют для получения П. металло-термич. способом, как компонент
фторидных лазерных материалов.
116,3 ДжДмоль-К);
получают взаимод. Рr6О11 с газообразным HF при 600 °С,
разложением фтораммониевых комплексов при 400-500 °С в атмосфере N2,
Аr и др.; применяют для получения П. металло-термич. способом, как компонент
фторидных лазерных материалов.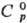 98,95
ДжДмоль·К);
98,95
ДжДмоль·К);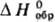 -1057,7 кДж/моль;
-1057,7 кДж/моль; 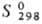 153,3 ДжДмоль · К); с НВг и HI легко переходит в соответствующие тригалогениды;
образует гидраты; получают взаимод. смеси С12 и СС14 с
оксалатом Рr выше 200 °С, хлорированием гидрата РгС13 тионилхлоридом
при нагр.; безродный РгС13 применяют для получения металлического
П., гексагидрат - для синтеза др. соединений Рr.
153,3 ДжДмоль · К); с НВг и HI легко переходит в соответствующие тригалогениды;
образует гидраты; получают взаимод. смеси С12 и СС14 с
оксалатом Рr выше 200 °С, хлорированием гидрата РгС13 тионилхлоридом
при нагр.; безродный РгС13 применяют для получения металлического
П., гексагидрат - для синтеза др. соединений Рr.