Химическая энциклопедия
"ПАЛЛАДИЙ"
Главная - Химическая энциклопедия - буква П - ПАЛЛАДИЙ
ПАЛЛАДИЙ
(назван в честь открытия планеты Паллада; лат. Palladium) Pd, хим. элемент VIII
гр. периодич. системы, ат. н. 46, ат. м. 106,42; относится к платиновым металлам.
Природный П. состоит из шести стабильных изотопов: 102Pd (1,00%),
104Pd (11,14%), 105Pd (22,33%), 106Pd (27,33%),
lo8Pd (26,46%) и 110Pd (11,72%). Наиб. долгоживущий искусств.
радиоактивный изотоп 107Pd (Т1/2 7·106
лет). Мн. изотопы П. в сравнительно больших кол-вах образуются при делении ядер
U и Pu. В совр. ядерных реакторах в 1 т. ядерного топлива при степени выгорания
3%, содержится 1,5 кг П. Поперечное сечение захвата тепловых нейтронов ок. 8·10-28
м2. Конфигурация внеш. электронной оболочки атома 4d10;
степени окисления 0, +1, +2 (наиб. часто), +3, + 4 (часто), +5, +6 (очень редко);
энергия ионизации Pd0 П.-один из наиб. редких
элементов, его средняя концентрация в земной коре 1·10-6 % по массе.
Встречается в самородном виде, в виде сплавов и соединений. Известно ок. 30
минералов, содержащих П.: аллопалладий (содержит примеси Hg, Pt, Ru, Сu), палладистая
платина (7-39% П.), палладит PdO, станнопалладинит Pd3Sn2,
стибиопаллади-нит Pd3Sb (содержит примеси PtAs2), брэггит
(Pd, Pt, Ni) S (16-20% П.) и др. Кол-во П. в смеси платиновых металлов в разл.
месторождениях колеблется от ~25% (ЮАР) до 43-45% (Канада) и 60% (СССР, по оценкам). Свойства. П.-серебристо-белый
металл с гранецентрир. кубич. решеткой типа Сu, а = 0,38902 нм, z = 4, пространств. группа Fm3m; т.пл. 1554°С, т. кип. 2940
°С; плотн. 12,02 г/см3; По хим. св-вам П. близок
к платине
и является наиб. активным платиновым металлом. При нагр. устойчив
на воздухе до ~ 300 °С, при 350-800 °С тускнеет из-за образования тонкой
пленки PdO, выше 850 °С PdO разлагается и вновь становится устойчивым на
воздухе. Хорошо раств. в царской водке. В отличие от др. платиновых металлов,
раств. в горячих конц. HNO3 и H2SO4. Переходит
в р-р при анодном растворении в соляной к-те. При комнатной т-ре взаимод. с
влажными Сl2 и Вг2, при нагр.-с F2, S, Se,
Те, As и Si. Характерная особенность П.-способность поглощать большие кол-ва
Н2 (до 900 объемов на 1 объем П.) благодаря образованию твердых р-ров
с увеличением параметра кристаллич. решетки; предполагается также образование
гидридов. Поглощенный Н2 легко удаляется из П. при нагр. до 100 °С
в вакууме. Явления, наблюдаемые при поглощении тяжелого изотопа водорода катодом
из П. в ходе электролиза D2O, принимались за свидетельство, "холодного"
ядерного синтеза. П. взаимод. с расплавл. KHS04, с Na2O2. Черный нерастворимый в
воде оксид PdO Гексафторид PdF6
получают взаимодействием П. с атомным F, красно-коричневый тетрафторид PdF4-фто-рированием
Pd2F6 под давлением F2 при 300-450 °С,
черный "три фторид" PdIIPdIVF6
и бледно-фиолетовый д и фторид PdF2 - взаимодействием П. или его
галогенидов с F2. Фториды П.-сильные окислители, термически неустойчивы
и легко гидролизуются водой. Существуют фторопаллада-ты(П и III) состава Дихлорид PdCl2-красные
кристаллы гексагон. синго-нии (т. пл. 680 °С, Коричневый дибромид PdBr2
(т.пл. 717°С, Сульфид PdS (т.пл. 970°С,
Коричнево-желтый нитрат
Pd(NO3)2 хорошо раств. в воде, гидролизуется при кипячении
водного р-ра. Выделен темно-красный сульфат PdSO4, его оливково-зеленый
моногидрат и красновато-коричневый дигидрат, к-рые легко гидролизуются. П. в степени окисления
+ 2 образует многочисл. комплексные соед. с лигандами, содержащими "мягкие"
доноры: CN-, P(III), As(III) и др. Для Pd(IV) наиб. типичны соед.,
содержащие ион [PdX6]2- (X = F, Cl, Вг). Известны соединения
с нейтральными группами типа Pd(aмин)2X4 и др. Получены
комплексные соед. Pd0, напр. [Pd(CN)4]4-, Pd(PF3)4
(т.пл. — 40°С). См. также Палладийорганические соединения
. Получение. Из технол. р-ра
благородных металлов в царской водке сначала осаждают Аи и Pt. Затем осаждают
Pd(NH3)2Cl2, к-рый очищают перекристаллизацией
из аммиачного р-ра НС1, высушивают и прокаливают в восстановит. атмосфере. Порошок
П. переплавляют. Восстановлением р-ров солей П. получают мелкокристаллический
П.-палладиевую чернь. Электроосаждение П. проводят из нитритных и фосфатных
кислых электролитов, в частности с использованием Na2[Pd(NO2)4]. В сер. 80-х гг. ежегодная
добыча П. в капиталистич. и развивающихся странах составляла 25-30 т. При этом
из вторичного сырья получали не более 10% П. По оценкам 2/3
мировой добычи П. падало на СССР. Применение. По объему годового
потребления в капиталистич. и развивающихся странах П. опережает др. платиновые
металлы. Из областей его применения наиб. важны медицина и стоматология (25-40%
ежегодного потребления), электротехника и электроника (30-40%), хим. пром-сть
(10-15%), автомобилестроение (5-15%), ювелирная (2-5%) и стекольная пром-сть
и др. Из П. и его сплавов изготовляют
мед. инструменты, детали кардиостимуляторов, зубные протезы, оправки, нек-рые
лек. ср-ва. В электронике используют, в частности, палладиевые пасты для произ-ва
больших интегральных схем, в электротехнике-электрич. контакты из П.; для этих
целей выпускают пружинящие контакты из П. с добавками Сг и Zr, а также сплавы
Pd-Ag и Pd-Cu. Способность П. растворять Н2 используют для тонкой
очистки Н2, каталитич. гидрирования и дегидрирования и др. Обычно
для этого используют сплавы с Ag, Rh и др. металлами, а также палладиевую чернь.
С сер. 70-х гг. 20 в. П. в виде сплавов с Pt стали использовать в катализаторах
дожигания выхлопных газов автомобилей. В стекольной пром-сти сплавы П. применяют
в тиглях для варки стекла, в фильерах для получения искусств. шелка и вискозной
нити. П. открыл У. Волластон
в 1803 при исследовании самородной платины. Лит. см. при ст.
Платиновые металлы
. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ПАЛЛАДИЙ
будет выглядеть так: Что такое ПАЛЛАДИЙ
 -> Pd+
-> Pd+  Pd2+
Pd2+  Pd3+
соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2;
атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd+f
0,073 нм (2), Pd2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd3
+ 0,090 нм (6).
Pd3+
соотв. равна 8,336, 19,428 и 32,92 эВ; электроотрицательность по Полингу 2,2;
атомный радиус 0,137 нм, ионные радиусы (в скобках даны координац. числа) Pd+f
0,073 нм (2), Pd2+ 0,078 нм (4, квадрат), 0,100 нм (6), Pd3
+ 0,090 нм (6).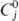 25,8 Дж/моль • К);
25,8 Дж/моль • К); 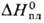 16,7 кДж/моль,
16,7 кДж/моль, 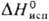 353 кДж/моль;
353 кДж/моль; 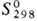 37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10-5
К-1 (273-373 К);
37,65 Дж/моль·К); температурный коэф. линейного расширения 1,17·10-5
К-1 (273-373 К); 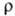 9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при
1554°С в вакууме. П. 99,998%-ной чистоты);
парамагнетик, уд. магн. восприимчивость + 5,231 · 10-б (20 °С);
работа выхода электрона 4,99 эВ. Для отожженного П. модуль упругости 117 ГПа,
сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39. П. упрочняется
при холодном деформировании, но становится мягче после отжига. Добавки нек-рых
в-в, особенно Ru и Ni, повышают твердость. П. легко поддается ковке, штамповке,
прокатке, протяжке, хорошо полируется и сваривается. Из него удается получать
тончайшие листы и тонкую проволоку.
9,96 мкОм • см (25 °С); теплопроводность 75,3 Вт/(м·К); g 0,015 Н/см (при
1554°С в вакууме. П. 99,998%-ной чистоты);
парамагнетик, уд. магн. восприимчивость + 5,231 · 10-б (20 °С);
работа выхода электрона 4,99 эВ. Для отожженного П. модуль упругости 117 ГПа,
сг 1,8-2,0 ГПа, относит. удлинение 25-40%; твердость по Виккерсу 37-39. П. упрочняется
при холодном деформировании, но становится мягче после отжига. Добавки нек-рых
в-в, особенно Ru и Ni, повышают твердость. П. легко поддается ковке, штамповке,
прокатке, протяжке, хорошо полируется и сваривается. Из него удается получать
тончайшие листы и тонкую проволоку.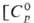 31 ДжДмоль • К),
31 ДжДмоль • К), 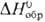 -15 кДж/моль,
-15 кДж/моль, 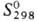 39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель.
Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH)2 (
39 ДжДмоль • К)] разлагается на простые в-ва выше 800-850 °С; сильный окислитель.
Гидролизом солей Pd(II,III,IV) выделены соотв. черный Pd(OH)2 (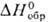 —161,1 кДж/моль), шоколад-но-черный Pd2O3·nH2O
и темно-красный PdO2. Оксиды Pd(III,IV)-сильные окислители; при небольшом
нагр. разлагаются до PdO.
—161,1 кДж/моль), шоколад-но-черный Pd2O3·nH2O
и темно-красный PdO2. Оксиды Pd(III,IV)-сильные окислители; при небольшом
нагр. разлагаются до PdO.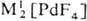 , МI[Рd2F5],
, МI[Рd2F5], 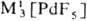 MII[PdF4],
MII[PdF4], 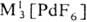 и др. Взаимодействием PdF6 с О2 получен оранжевый гексафторопалладат(V)
диоксигенила O2PdF6.
и др. Взаимодействием PdF6 с О2 получен оранжевый гексафторопалладат(V)
диоксигенила O2PdF6. —163 кДж/моль); легко раств. в воде, в соляной к-те, давая тетрахлоропалладие-вую(П)
к-ту H2[PdCl4]; получают из простых в-в выше 500 °С.
При растворении в царской водке П. образует гекса-хлоропалладиевую(IV) к-ту
H2[PdCl6], разлагающуюся при кипячении до Н2
[PdCl4] и Сl2. Выделены многочисл. хлоропалладаты(IV)
M2[PdCl6] и хлоропалладаты(II) M2[PdCl4],
а также их производные, св-ва к-рых используют для выделения и аффинажа П. Так,
в хлоридном р-ре, содержащем NH3, П. может образовывать плохо р-римый
хлоропалладозамин Pd(NH3)2Cl2 (слабокислая
среда), нерастворимую соль Вокелена [Pd(NH3)4] [PdCl4]
или р-римый дихлорид тетрамминопалладия (II) Pd(NH3)4Cl2
(сильно щелочная среда). Р-р солей Pd2+ сначала сильно подщелачивают,
отделяя осадки гидроксидов металлов (примесей), а затем подкисляют, выделяя
П. в осадок. Осадок Pd(NH3)2Cl2 термически
разлагают при 800-900 °С до металла.
—163 кДж/моль); легко раств. в воде, в соляной к-те, давая тетрахлоропалладие-вую(П)
к-ту H2[PdCl4]; получают из простых в-в выше 500 °С.
При растворении в царской водке П. образует гекса-хлоропалладиевую(IV) к-ту
H2[PdCl6], разлагающуюся при кипячении до Н2
[PdCl4] и Сl2. Выделены многочисл. хлоропалладаты(IV)
M2[PdCl6] и хлоропалладаты(II) M2[PdCl4],
а также их производные, св-ва к-рых используют для выделения и аффинажа П. Так,
в хлоридном р-ре, содержащем NH3, П. может образовывать плохо р-римый
хлоропалладозамин Pd(NH3)2Cl2 (слабокислая
среда), нерастворимую соль Вокелена [Pd(NH3)4] [PdCl4]
или р-римый дихлорид тетрамминопалладия (II) Pd(NH3)4Cl2
(сильно щелочная среда). Р-р солей Pd2+ сначала сильно подщелачивают,
отделяя осадки гидроксидов металлов (примесей), а затем подкисляют, выделяя
П. в осадок. Осадок Pd(NH3)2Cl2 термически
разлагают при 800-900 °С до металла.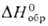 — 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают
растворением Pd в смеси бромистоводородной к-ты и Вг2. Черный дииодид
PdI2 (
— 120 кДж/моль) плохо раств. в воде, лучше-в бромисто-водородной к-те. Его получают
растворением Pd в смеси бромистоводородной к-ты и Вг2. Черный дииодид
PdI2 (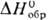 — 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl2, образует
иодопалладаты(II), напр. K2[PdI4].
— 63 кДж/моль) не раств. в воде, осаждается из р-ров PdCl2, образует
иодопалладаты(II), напр. K2[PdI4].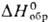 -77,0
кДж/моль), дисульфид PdS2 и др. сульфиды П. не раств. в воде. Известны
селениды PdSe, PdSe2, Pd4Se, теллуриды PdTe, PdTe2,
Pd2Te, Pd3Te, Pd5Te2, фосфиды PdP2,
Pd3P, Pd5P, Pd5P2, арсениды PdAs,
Pd2As, Pd3As, Pd3As2, силициды PdSi,
Pd2Si и Pd3Si.
-77,0
кДж/моль), дисульфид PdS2 и др. сульфиды П. не раств. в воде. Известны
селениды PdSe, PdSe2, Pd4Se, теллуриды PdTe, PdTe2,
Pd2Te, Pd3Te, Pd5Te2, фосфиды PdP2,
Pd3P, Pd5P, Pd5P2, арсениды PdAs,
Pd2As, Pd3As, Pd3As2, силициды PdSi,
Pd2Si и Pd3Si.