Химическая энциклопедия
"АКТИВИРОВАННОГО КОМПЛЕКСА ТЕОРИЯ"
Главная - Химическая энциклопедия - буква А - АКТИВИРОВАННОГО КОМПЛЕКСА ТЕОРИЯ
АКТИВИРОВАННОГО КОМПЛЕКСА ТЕОРИЯ
(теория переходного
состояния, теория абс. скоростей р-ций), простейший и исторически первый
вариант статистич. теории хим. р-ций. Разработана Э. Вигнером, М. Поляни,
Г. Эйрингом, М. Эвансом в 30-х гг. 20 в. Позволяет приближенно рассчитывать
скорость элементарных термич. хим. р-ций, исходя из электронного строения
и св-в молекул реагентов. В основе теории лежит фундаментальное для химии
понятие многомерной поверхности потенциальной энергии
(ППЭ) р-ции.
Для микроскопия, системы частиц (атомов, молекул), между к-рыми может происходить
р-ция (в дальнейшем такую систему будем называть химической), ППЭ - ф-ция
потенциальной энергии атомных ядер U от их внутр. координат, или
степеней свободы. В системе из п ядер число внутр. степеней свободы
N = 3n — 6 (или 3n — — 5, если все ядра расположены на одной прямой
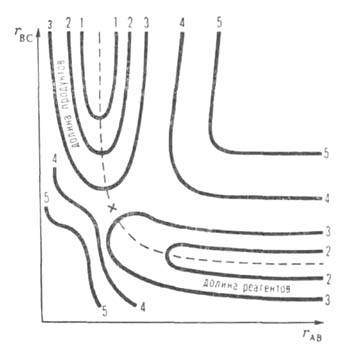
линии). Простейшая двухмерная (N = 2) ППЭ показана на рис. 1. Реагентам
и продуктам р-ции на ней соответствуют области относительно небольшой потенциальной
энергии (долины), разделенные областью повыш. энергии-потенциальным барьером.
Кривая линия, проходящая по дну долин через барьер,-координата реакции
.
Часто используют одномерные схемы, изображающие сечение ППЭ, развернутое
вдоль координаты р-ции (см. рис. 2). На этих схемах вершине потенциального
барьера соответствует седло-вая точка, или точка перевала. Эти же понятия
переносят на многомерные ППЭ с 2>N > 2
. Состояния реагентов и продуктов
устойчивы, им соответствуют конфигурации (т.е. фиксированные значения координат
ф), к-рые являются минимумами (или долинами) на многомерной ППЭ. Хим. р-ция
рассматривается как переход из конфигурации реагентов в конфигурацию продуктов
через конфигурацию седловой точки вдоль координаты р-ции. Конфигурации
как минимумов, так и седловых точек-стационарные точки ППЭ, т.е. в них Рис. 1. AB + C ПP PACПOЛOЖEH BCEX TPEX ATOM A>Простейшая ППЭ для р-ции А + ВС -> АВ + С при расположении всех трех атомов А, В и С на одной прямой (угловые движения игнорируются). По координатным осям отложены межатомные расстояния rBC и rАВ- Кривые 1-5-уровни постоянной энергии (в условных единицах). Пунктиром обозначена координата р-ции, крестом-седловая точка.
Рис. 2. Профиль ППЭ вдоль координаты р-ции. Вертикальные пунктирные линии ограничивают область, соответствующую активированному комплексу на координате р-ции (ее размер А. к. т. исходит из предположения о том, что скорость р-ции определяется св-вами нек-рой выделенной геом. конфигурации хим. системы. Обычно принимают, что эта конфигурация соответствует седловой точке на ППЭ; ее наз. активированным комплексом (АК), или переходным состоянием. На одномерной схеме (см. рис. 2) границы конфигурации АК определяются произвольно малой длиной 5 вблизи вершины барьера. Уравнение для скорости реакции. В седловой точке ППЭ с координатами где k и А. к. т. постулирует термодинамич. равновесие между реагентами и АК,
характеризуемое константой где В ранних формулировках А. к. т. гипотеза о равновесии между реагентами
и АК трактовалась буквально и к при равнивалась произведению частоты распада
АК 1/ Величины Рассматривая в (3) Величины Совр. вывод ур-ния (2), химически менее наглядный, основан на столкновений теории
. Скорость р-ции отождествляется со скоростью перехода реагирующих
хим. систем через (N — 1 )-мерную пов-сть в пространстве конфигураций,
разделяющую области реагентов и продуктов. В теории столкновений эта скорость
наз. потоком через критич. пов-сть. Ур-ние в форме (2) получается, если
провести критич. пов-сть через седловую точку ортогонально координате р-ции
и принять, что на критич. пов-сти энергетич. распределение реагентов равновесно.
Соответствующая область пространства координат и импульсов (фазового пространства)
характеризуется той же статистич. суммой Применение теории. Согласно теории, механизм р-ции вполне определен
конфигурациями реагентов и продуктов (минимумы, или долины, на ППЭ) и соответствующих
АК (седловые точки). Теоретич. расчет этих конфигураций методами квантовой
химии дал бы исчерпывающую информацию о направлениях и скоростях хим. р-ций.
Такие расчеты интенсивно развиваются; для простых хим. систем, содержащих
10-15 атомов, к-рые принадлежат к элементам первых двух периодов таблицы
Менделеева, они практически реализуемы и достаточно надежны. Последоват.
расчет абс. скорости р-ции по ур-нию (2) заключается в определении геом.
конфигураций реагентов и АК (на этом этапе также определяется высота потенциального
барьера) и вычислении для этих конфигураций моментов инерции и колебат.
частот, к-рые необходимы для расчета статистич. сумм и окончат. определения А. к. т.-основа качеств. представлений о реакц. способности в-в. Ур-ния
(2), (3) и (5) имеют ту же форму, что и ур-ние Аррениуса, к-рое эмпирически
описывает температурную зависимость кинетич. констант разл. хим. процессов.
Величину Ограниченность теории и попытки ее совершенствования. А. к. т. основана на двух предположениях. Первое-гипотеза о термодинамич. равновесии между реагентами и АК. Согласно второму, скорость р-ции отождествляется со скоростью распада АК. Оба предположения нельзя строго обосновать. Это обнаруживается, если рассматривать движение хим. системы вдоль координаты р-ции на всем пути от реагентов к продуктам, а не только вблизи вершины потенциального барьера. Координату р-ции лишь в редких случаях правильно считать прямой линией, как на рис. 2. Обычно же она-кривая в многомерном пространстве внутр. переменных и является сложной комбинацией элементарных движений, к-рая неодинакова на разл. своих участках. Напр., на рис. 1 координата р-ции-это непрерывно изменяющаяся комбинация двух валентных колебаний. Равновесное распределение энергии в реагентах для термич. р-ций обеспечено
практически всегда; оно нарушается только в чрезвычайно быстрых процессах.
Проблема в том, сохранится ли оно в АК. Из-за криволинейности координату
р-ции нельзя считать независимой степенью свободы. Ее взаимод. с другими,
поперечными движениями приводит к обмену энергией между ними. В результате,
во-первых, может нарушиться первоначально равновесное распределение энергии
по поперечным степеням свободы и, во-вторых, система может вернуться в
область реагентов даже после того, как она уже прошла через конфигурацию
АК в направлении продуктов. Наконец, необходимо иметь в виду, что, согласно
ур-ниям (2), (3) и (5), хим. р-ция рассматривается как классич. переход;
игнорируются квантовые особенности, напр. электронно-неадиабатич. процессы
и туннельный эффект. В ранних формулировках теории в ур-ния (2), (3) и
(5) добавляли т. наз. трансмиссионный множитель Последоват. неформальное рассмотрение всех указанных эффектов возможно лишь в рамках динамич. расчета (см. Динамика элементарного акта ). Предпринимались попытки учесть их по отдельности. Напр., был предложен метод си-стематич. уточнения конфигурации АК, поскольку выбор в кач-ве таковой именно седловой точки основан на интуитивных представлениях и, вообще говоря, не обязателен. Могут существовать и др. конфигурации, для к-рых погрешность вычислений по ф-лам (2) и (3), обусловленная возвращением системы в область реагентов после прохождения этих конфигураций, меньше, чем для конфигурации седловой точки. Используя формулировку А. к. т. в терминах теории столкновений (см. выше), можно утверждать, что обратному потоку (от продуктов к реагентам) через критич. пов-сть соответствует порождающая его и равная ему часть полного прямого потока (от реагентов к продуктам). Чем меньше эта часть, тем точнее вычисление скорости р-ции по А. к. т. Эти соображения легли в основу т. наз. вариационного определения АК, согласно к-рому критической считается пов-сть, минимизирующая прямой поток. Для нее скорость р-ции, вычисляемая по ур-ниям (2) и (3), минимальна. Как правило, нулевые энергии поперечных колебаний изменяются вдоль координаты р-ции. Это еще одна причина смещения конфигурации АК из седловой точки ППЭ; она также учитывается вариационной теорией. Значит. внимание уделялось разработке методов определения вероятностей квантового туннелирования в хим. р-циях. Наконец, стали возможны оценки трансмиссионного множителя в рамках модельных динамич. вычислений. При этом предполагается, что с постулат. движением системы вдоль координаты р-ции взаимодействуют не все, а лишь нек-рые из поперечных степеней свободы. Они и учитываются в квантовом динамич. расчете; остальные степени свободы обрабатываются в рамках равновесной теории. При таких вычислениях автоматически определяются также и поправки на квантовое туннелирование. Упомянутые усовершенствованные методы расчета абс. скоростей хим. р-ций требуют серьезных вычислит. усилий и лишены универсальности А. к. т. Лит.: Глесстон С, Лейдлер К., Эйринг Г., Теория абсолютных скоростей
реакций, пер. с англ., М., 1948; Лейдлер К., Кинетика органических реакций,
пер. с англ., М., 1966: Термические бимолекулярные реакции в газах, М.,
1976. М. В. Базилевский.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: АКТИВИРОВАННОГО КОМПЛЕКСА ТЕОРИЯ
будет выглядеть так: Что такое АКТИВИРОВАННОГО КОМПЛЕКСА ТЕОРИЯ
 U/
U/ qi
= 0.
qi
= 0.
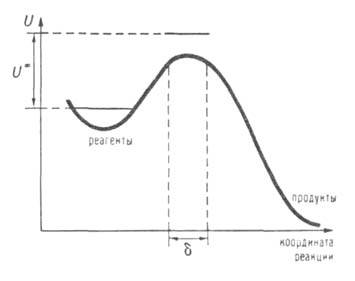
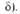 Горизонтальные сплошные линии-нулевые колебат. уровни энергии для реагентов и комплекса.
Горизонтальные сплошные линии-нулевые колебат. уровни энергии для реагентов и комплекса.
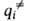 (i
= 1, 2, ..., N)все первые производные ф-ции U(qi)равны нулю, так что разложение ф-ции по отклонениям (qi
—
(i
= 1, 2, ..., N)все первые производные ф-ции U(qi)равны нулю, так что разложение ф-ции по отклонениям (qi
—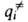 ) начинается
с квадратичных членов. Это означает, что для АК можно определить N нормальных
колебаний (мод), как и для обычных устойчивых молекул, а также ввести вращат.
и постулат. степени свободы, характеризующие движение АК как целого. Однако
в отличие от устойчивой молекулы, к-рой соответствует на ППЭ не сед-ловая
точка, а минимум, для АК одна из нормальных мод, а именно движение вдоль
координаты р-ции, приводит к его распаду; частота этой моды-чисто мнимая
величина. Неустойчивая конфигурация АК характеризуется временем жизни:
) начинается
с квадратичных членов. Это означает, что для АК можно определить N нормальных
колебаний (мод), как и для обычных устойчивых молекул, а также ввести вращат.
и постулат. степени свободы, характеризующие движение АК как целого. Однако
в отличие от устойчивой молекулы, к-рой соответствует на ППЭ не сед-ловая
точка, а минимум, для АК одна из нормальных мод, а именно движение вдоль
координаты р-ции, приводит к его распаду; частота этой моды-чисто мнимая
величина. Неустойчивая конфигурация АК характеризуется временем жизни:

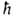 -постоянные
Больцмана и Планка соотв., Т-абс. т-ра. При обычных для хим. р-ций т-рах
-постоянные
Больцмана и Планка соотв., Т-абс. т-ра. При обычных для хим. р-ций т-рах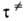 ~10-13с.
~10-13с.
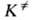 .
На этом основании константа скорости хим. р-ции к выражается ур-ниями:
.
На этом основании константа скорости хим. р-ции к выражается ур-ниями:
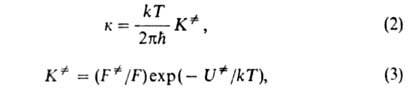
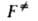 и F-отнесенные к единице объема статистич. суммы АК и реагентов соотв.,
и F-отнесенные к единице объема статистич. суммы АК и реагентов соотв.,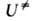 -изменение
потенциальной энергии системы при переходе от реагентов к АК. Величина
-изменение
потенциальной энергии системы при переходе от реагентов к АК. Величина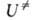 складывается
из высоты потенциального барьера и разности нулевых колебат. энергий АК
и реагентов (см. рис. 2). В ф-ле (3) она приведена в расчете на 1 АК; обычно
же ее относят к NA = 6,02*1023 АК; тогда в показателе
экспоненты k заменяют газовой постоянной R. При вычислении
статистич. суммы
складывается
из высоты потенциального барьера и разности нулевых колебат. энергий АК
и реагентов (см. рис. 2). В ф-ле (3) она приведена в расчете на 1 АК; обычно
же ее относят к NA = 6,02*1023 АК; тогда в показателе
экспоненты k заменяют газовой постоянной R. При вычислении
статистич. суммы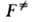 учитывают все степени свободы АК, кроме движения по координате р-ции, а
именно постулат. и вращат. движения АК как целого и (
учитывают все степени свободы АК, кроме движения по координате р-ции, а
именно постулат. и вращат. движения АК как целого и (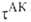 на константу
равновесия К :
на константу
равновесия К :

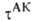 и КАК вычисляются обычными методами статистич. механики; обе
они пропорциональны длине
и КАК вычисляются обычными методами статистич. механики; обе
они пропорциональны длине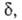 определяющей границы конфигурации АК на координате р-ции. Поскольку их
отношение (4) не зависит от
определяющей границы конфигурации АК на координате р-ции. Поскольку их
отношение (4) не зависит от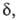 эти границы условны, ур-ния (2) и (3) получаются из (4) при произвольном
выборе значения
эти границы условны, ур-ния (2) и (3) получаются из (4) при произвольном
выборе значения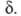 Выражение
К через статистич. суммы аналогично ф-ле (3), но вместо
Выражение
К через статистич. суммы аналогично ф-ле (3), но вместо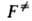 используют полную статистич. сумму АК F = f
используют полную статистич. сумму АК F = f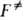 ,
где f -элементарная статистич. сумма для движения системы вдоль
координаты р-ции; именно она пропорциональна
,
где f -элементарная статистич. сумма для движения системы вдоль
координаты р-ции; именно она пропорциональна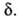 Можно
ввести спец. определение АК, выбрав
Можно
ввести спец. определение АК, выбрав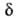 т.
обр., чтобы для
т.
обр., чтобы для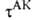 и К получились в точности выражения (1) и (3), т.е. положив
и К получились в точности выражения (1) и (3), т.е. положив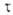 АК
=
АК
=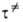 и КАК
=
и КАК
=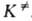 . При этом
f= 1 и FAK =
. При этом
f= 1 и FAK =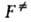 .
Тогда термодинамич. интерпретация ур-ния (2) становится особенно наглядной;
соответствующее значение
.
Тогда термодинамич. интерпретация ур-ния (2) становится особенно наглядной;
соответствующее значение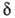 составляет ок. 1 нм.
составляет ок. 1 нм.
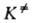 как
константу равновесия, можно представить (2) в термодинамич. форме:
как
константу равновесия, можно представить (2) в термодинамич. форме:
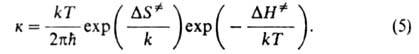
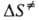 и
и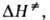 наз.
соотв. энтропией и энтальпией активации, представляют собой изменения энтропии
и энтальпии системы при переходе от реагентов к АК. Как правило, осн. вклад
в
наз.
соотв. энтропией и энтальпией активации, представляют собой изменения энтропии
и энтальпии системы при переходе от реагентов к АК. Как правило, осн. вклад
в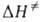 дает
дает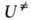 ,
а
,
а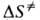 определяется
в осн. статистич. суммами:
определяется
в осн. статистич. суммами: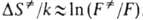 ;
исключением м.б. р-ции в полярных р-рителях. Ур-ния (2) и (3) применяют
к газофазным р-циям, а (5)-для расчета скоростей р-ций в р-рах, когда вычисления
статистич. сумм затруднительны. Соотв. предполагается, что в первом случае
р-ция протекает при постоянном объеме, во втором-при постоянном давлении.
;
исключением м.б. р-ции в полярных р-рителях. Ур-ния (2) и (3) применяют
к газофазным р-циям, а (5)-для расчета скоростей р-ций в р-рах, когда вычисления
статистич. сумм затруднительны. Соотв. предполагается, что в первом случае
р-ция протекает при постоянном объеме, во втором-при постоянном давлении.
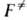 . Это позволяет рассматривать критич. пов-сть как множество конфигураций
АК. Т. обр., АК сразу определяется как объект с (N — 1) внутр. степенями
свободы и не нужно вводить его протяженность
. Это позволяет рассматривать критич. пов-сть как множество конфигураций
АК. Т. обр., АК сразу определяется как объект с (N — 1) внутр. степенями
свободы и не нужно вводить его протяженность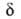 вдоль координаты р-ции.
вдоль координаты р-ции.
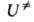 .
В применении к сложным р-циям, представляющим практич. интерес, полная
и надежная реализация такой программы трудоемка и зачастую неосуществима.
Поэтому молекулярные постоянные, необходимые для вычислений по ур-ниям
(2) и (3), часто находят эмпирич. методами. Для устойчивых конфигураций
реагентов моменты инерции и колебат. частоты обычно известны из спектроскопич.
данных, однако для АК эксперим. определение их невозможно ввиду малого
впемени его жизни. Если последоват. квантовохим. расчет
.
В применении к сложным р-циям, представляющим практич. интерес, полная
и надежная реализация такой программы трудоемка и зачастую неосуществима.
Поэтому молекулярные постоянные, необходимые для вычислений по ур-ниям
(2) и (3), часто находят эмпирич. методами. Для устойчивых конфигураций
реагентов моменты инерции и колебат. частоты обычно известны из спектроскопич.
данных, однако для АК эксперим. определение их невозможно ввиду малого
впемени его жизни. Если последоват. квантовохим. расчет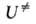 и
и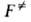 недоступен, для оценки этих величин применяют интерполяционные расчетные
схемы.
недоступен, для оценки этих величин применяют интерполяционные расчетные
схемы.
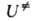 во мн. случаях достаточно отождествить с наблюдаемой энергией активации,
пренебрегая слабой (по сравнению с экспоненциальной) температурной зависимостью
статистич. сумм и множителя k Т/
во мн. случаях достаточно отождествить с наблюдаемой энергией активации,
пренебрегая слабой (по сравнению с экспоненциальной) температурной зависимостью
статистич. сумм и множителя k Т/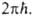 Тогда пред-экспоненциальный множитель в ур-ниях (2) и (3) можно отождествить
с аррениусовским. Его значение слабо зависит от деталей строения АК и оценка
по порядку величины не составляет труда. Оказывается, что в реакц. сериях
с одинаковым реакц. центром предэкспоненциальный множитель примерно постоянен,
т.е. ряды активности определяются значениями энергии активации. Наконец,
если пренебречь вкладом нулевых колебат. энергий в
Тогда пред-экспоненциальный множитель в ур-ниях (2) и (3) можно отождествить
с аррениусовским. Его значение слабо зависит от деталей строения АК и оценка
по порядку величины не составляет труда. Оказывается, что в реакц. сериях
с одинаковым реакц. центром предэкспоненциальный множитель примерно постоянен,
т.е. ряды активности определяются значениями энергии активации. Наконец,
если пренебречь вкладом нулевых колебат. энергий в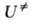 ,
высота потенциального барьера р-ции становится единственной фундам. характеристикой
ее скорости. Для теоретич. оценки относит. изменений высоты потенциального
барьера в реакц. сериях разработаны простые методы (см.
,
высота потенциального барьера р-ции становится единственной фундам. характеристикой
ее скорости. Для теоретич. оценки относит. изменений высоты потенциального
барьера в реакц. сериях разработаны простые методы (см.  Предполагалось,
что в нем собрано влияние перечисленных выше факторов, не учтенных при
выводе этих ур-ний. Т. обр., определение х выходит за рамки А.к.т.; более
того, для р-ций, в к-рых х значительно отличается от единицы, теория теряет
смысл. Однако для сложных р-ций предположение
Предполагалось,
что в нем собрано влияние перечисленных выше факторов, не учтенных при
выводе этих ур-ний. Т. обр., определение х выходит за рамки А.к.т.; более
того, для р-ций, в к-рых х значительно отличается от единицы, теория теряет
смысл. Однако для сложных р-ций предположение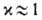 не противоречит экспе-рим. данным, и именно этим объясняется популярность
А. к. т.
не противоречит экспе-рим. данным, и именно этим объясняется популярность
А. к. т.