Химическая энциклопедия
"ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ"
Главная - Химическая энциклопедия - буква О - ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
, пути изменения состояния термодинамич. системы.
Процесс наз. обратимым, если он допускает возвращение рассматриваемой системы
из конечного состояния в исходное через ту же последовательность промежут. состояний,
что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное
состояние возвращается не только система, но и среда. Обратимый процесс возможен,
если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается,
что равновесие существует между отдельными частями рассматриваемой системы и
на границе с окружающей средой. Обратимый процесс - идеализир. случай, достижимый
лишь при бесконечно медленном изменении термодинамич. параметров. Скорость установления
равновесия должна быть больше, чем скорость рассматриваемого процесса. Если
невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное
состояние, процесс изменения состояния системы наз. необратимым. Необратимые процессы могут
протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность,
вязкое течение и др. Для хим. р-ции применяют понятия термодинамич. и кинетич.
обратимости, к-рые совпадают только в непосредств. близости к состоянию равновесия.
Р-ция А + В На практике нередко встречаются
системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению
к определенного рода процессам, тогда как в целом система неравновесна. Напр.,
образец закаленной стали обладает пространств. неоднородностью и является системой,
неравновесной по отношению к диффузионным процессам, однако в этом образце могут
происходить равновесные циклы мех. деформации, поскольку времена релаксации
диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно,
процессы с относительно большим временем релаксации являются кинетически заторможенными
и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов. Необратимые процессы сопровождаются
диссипатив-ными эффектами, сущностью к-рых является производство (генерирование)
энтропии в системе в результате протекания рассматриваемого процесса. Простейшее
выражение закона диссипации имеет вид: где Обратимые процессы, будучи
идеализированными, не сопровождаются диссипативными эффектами. Микроско-пич.
теория О. и н. п. развивается в статистической термодинамике
. Системы,
в к-рых протекают необратимые процессы, изучает термодинамика необратимых процессов
. Лит. см. при ст.
Химическая термодинамика. Е. П. Агеее. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
будет выглядеть так: Что такое ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
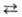 С
+ D наз. кинетически обратимой или двусторонней, если в данных условиях продукты
С и D могут реагировать друг с другом с образованием исходных в-в А и В. При
этом скорости прямой и обратной р-ций, соотв.
С
+ D наз. кинетически обратимой или двусторонней, если в данных условиях продукты
С и D могут реагировать друг с другом с образованием исходных в-в А и В. При
этом скорости прямой и обратной р-ций, соотв.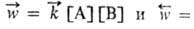
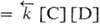 , где
, где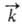 и
и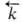 -константы
скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением
времени становятся равными и наступает
-константы
скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением
времени становятся равными и наступает 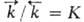
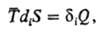
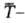 средняя
т-ра, di
средняя
т-ра, di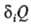 - т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
- т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).