Химическая энциклопедия
"НИТРИТЫ НЕОРГАНИЧЕСКИЕ"
Главная - Химическая энциклопедия - буква Н - НИТРИТЫ НЕОРГАНИЧЕСКИЕ
НИТРИТЫ НЕОРГАНИЧЕСКИЕ
,
соли азотистой к-ты HNO2. Используют прежде всего нитриты (Н.)
щелочных металлов
и аммония, меньше-щел.-зем. и 3d-металлов, Рb и
Ag. О Н. остальных металлов имеются только отрывочные сведения. Н. металлов в степени окисления
+2 образуют кристаллогидраты с одной, двумя или четырьмя молекулами воды. Н.
образуют двойные и тройные соли, напр. CsNO2 x х AgNO2
или Ba(NO2)2•Ni(NO2)2•2KNO2,
а также комплексные соед., напр. Na3[Co(NO2)6]. Кристаллич. структуры известны
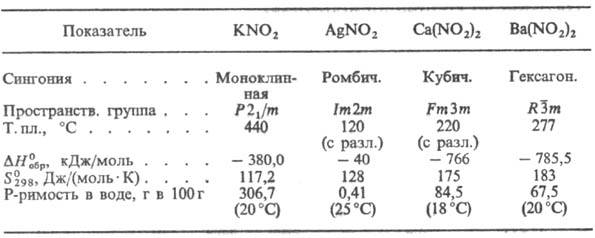
лишь для неск. безводных Н. (см. табл.). Анион NO-2 имеет
нелинейную конфигурацию; угол ONO 115°, длина связи N—О 0,115 нм; тип связи
М—NO2 ионно-ковалентный. СВОЙСТВА НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ
НИТРИТОВ Хорошо раств. в воде нитриты
К, Na, Ba, плохо-нитриты Ag, Hg, Сu. С повышением т-ры р-римость Н. увеличивается.
Почти все Н. плохо раств. в спиртах, эфирах и малополярных р-рителях. Н. термически малоустойчивы;
плавятся без разложения только Н. щелочных металлов, Н. остальных металлов разлагаются
при 25-300 °С. Механизм разложения Н. сложен и включает ряд параллельно-последоват.
р-ций. Осн. газообразные продукты разложения-NO, NO2, N2
и О2, твердые-оксид металла или элементный металл. Выделение большого
кол-ва газов обусловливает взрывное разложение нек-рых Н., напр. NH4NO2,
к-рый разлагается на N2 и Н2О. Характерные особенности
Н. связаны с их термич. нестойкостью и способностью нитрит-иона быть как окислителем,
так и восстановителем, в зависимости от среды и природы реагентов. В нейтр.
среде Н. обычно восстанавливаются до NO, в кислой окисляются до нитратов. Кислород
и СО2 не взаимод. с твердыми Н. и их водными р-рами. Н. способствуют
разложению азотсодержащих орг. в-в, в частности аминов, амидов и др. С орг.
галогенидами RX Н. реагируют с образованием как нитритов RONO, так и нитросоединений
RNO2. Пром. получение Н. основано
на абсорбции нитрозно-го газа (смеси NO + NO2) р-рами Na2CO3
или NaOH с послед. кристаллизацией NaNO2; H. остальных металлов в
пром-сти и лабораториях
получают обменной р-цией солей металлов с NaNO2 или восстановлением
нитратов этих металлов. Анализ Н. на нитрит-ион
основан на его восстановлении сплавом Деварда (50% Сu, 45% Аl, 5% Zn) до NH3
и поглощении NH3 титрованными р-рами к-т. См. также Натрия нитрит
. Н. применяют для синтеза
азокрасителей, в произ-ве капролактама, в качестве окислителей и восстановителей
в резинотехн., текстильной и металлообрабатывающей пром-сти, как консерванты
пищ. продуктов. Н., напр. NaNO2 и KNO2, токсичны, вызывают
головную боль, рвоту, угнетают дыхание и т.д. При отравлении NaNO2
в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно
образование нитрозаминов из NaNO2 и аминов непосредственно в желудочно-кишечном
тракте. Лит.: Миниович М.
А., Миниович В. М., Соли азотистой кислоты. Нитриты, М., 1979. П.М. Чукуров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: НИТРИТЫ НЕОРГАНИЧЕСКИЕ
будет выглядеть так: Что такое НИТРИТЫ НЕОРГАНИЧЕСКИЕ