Химическая энциклопедия
"НИТРАМИНЫ"
Главная - Химическая энциклопедия - буква Н - НИТРАМИНЫ
НИТРАМИНЫ
(N-нитроамины),
соед. общей ф-лы RRNNO2. Различают первичные Н. (R = Н) и вторичные
Н. (R,R = Alk, Ar). Известны также N,N-динитрамины общей ф-лы RN(NO2)2
(R = Alk) и N-нитрамиды общей ф-лы RN(NO2)X (R = Н, Alk, Ar; X =
COOAlk, CO Alk, SO2Alk и т. п.). Названия Н. производят прибавлением
слова "нитра-мин" к назв. орг. радикала, или префикса "N-нитро"
к номенклатурному назв. амина, либо префикса "нитрамино" к назв.
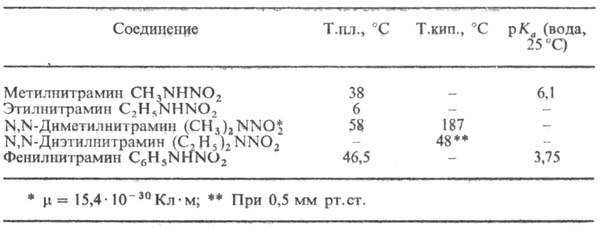
соединения-основы. Низшие Н., как правило,
жидкости, масла или низкоплавкие твердые в-ва (см. табл.), хорошо раств. во
мн. орг. р-рителях. Первичные Н. и N-нитрамиды легко раств. в воде. Большинство
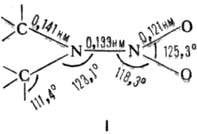
Н. взрывоопасны. АТОМЫ фрагмента C2N2O2 расположены
практически в одной плоскости (длины связей и углы показаны на ф-ле I).
В И К спектрах Н. присутствуют
две характеристич. полосы, соответствующие симметричным колебаниям группы NO2
при 1270-1310 см-1
и антисимметричным колебаниям при 1550-1630
(для первичных Н.) и 1500-1550 см-1 (для вторичных Н.);
в УФ спектре Н.-полоса 225-250 нм (e Первичные Н.-слабые к-ты,
поэтому для них характерно равновесие: RNHO2+HO- СВОЙСТВА НЕКОТОРЫХ НИТРАМИНОВ С основаниями они образуют
достаточно стабильные соли, к-рые при осторожном подкислении переходят в исходные
Н. Алкилирование первичных Н. или их солей алкилгало-генидами, диэтилсульфатом
или диазоалканами приводит к N- и О-производным, напр.: Соотношение продуктов р-ции
зависит от природы реагентов и условий процесса. При ацилировании солей Н. образуются
либо N-производные, либо сложные эфиры, напр.: Алифатич. первичные Н.
восстанавливаются амальгамой Na и др. восстановителями в щелочной среде через
диазо-соед. до спиртов, ароматические - до диазониевых катионов (ArN2)+
. При восстановлении вторичных Н. LiAlH4 или Zn в кислой среде образуются
несимметричные гидразины или в результате разрыва связи N—N соответствующие
амины и NH3. Первичные Н, быстро разлагаются
водными к-тами с выделением N2O; при действии HNO2 образуются
спирты, вторичные Н. и их О-изомеры, напр.: Вторичные Н. более устойчивы
к к-там, однако конц. H2SO4 разлагает их до альдегидов
и HNO2. Ароматические Н. под действием минер. к-т претерпевают миграцию
группы NO2 в ядро, обычно в орто-
, реже в nара-положение. Первичные Н. обратимо присоединяются
к формальдегиду (р-ция 1), легко вступают в р-цию Манниха (2,3), присоединяются
к соед. с активир. двойной связью (р-ция Михаэля, 4), конденсируются с ароматич.
диазосоед. (5), а также раскрывают oксирaновый цикл, образуя b-нитррами-нoспирты; Соли первичных Н. можно
фторировать F2 по атому азота или цианировать бромцианом. Ароматич.
первичные Н. и N-нитрамиды легко хлорируются HClO, давая нестабильные N-хлррпрризррдные. Н. получают с высоким выходом
(50-80%) при нитро-вднии аминов нитратом ацетонциангидрина, а также окислением
N-нитрозoсред, действием CF3CO3H. Для получения первичных
Н. используют нитрование нитрующими смесями [HNO3/H2SO4
или HNO3/(CH3CO)2O] амидов, урета-нов или N,N-дихлораминов
(с послед. восстановлением): Вторичные Н. получают нитрованием
соответствующих амидов (выход 40-90%), напр. RRNCOR: + HNO3
Для качеств. обнаружения
Н. используют пробу Франши-мона: образование интенсивной зеленой окраски при
взаи-мод. р-ра Н. в уксусной к-те с диметиламином в присут. Zn-пыли. Н. применяют в качестве
бризантных ВВ (гексаген, окто-ген), компонентов взрывчатых и пороховых
составов, гербицидов, стимуляторов роста, антисептиков, присадок к смазочным
маслам и топливам, в качестве физиологически активных соед. и др. Лит.: Фридман А.
Л., Ившин В. П., Новиков С. С., "Успехи химии", 1969, т. 38, в.
8, с. 1448-78; Химия нитро- и нитрозогрупп, пер. с англ., т. 1, М., 1972, с.
467-522; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 459-65. С.Л.Иоффе. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: НИТРАМИНЫ
будет выглядеть так: Что такое НИТРАМИНЫ
 5-7.103), отвечающая p
5-7.103), отвечающая p  p*-переходу.
В спектрах ПМР хим. сдвиг a-Н-атома уширен благодаря взаимод. с ядром 14N
группы NO2. В спектрах ЯМР на ядрах N хим. сдвиг 5 от —20 до —
50м. д. (группа NO2) и от —150 до — 250 м.д. (аминогруппа).
p*-переходу.
В спектрах ПМР хим. сдвиг a-Н-атома уширен благодаря взаимод. с ядром 14N
группы NO2. В спектрах ЯМР на ядрах N хим. сдвиг 5 от —20 до —
50м. д. (группа NO2) и от —150 до — 250 м.д. (аминогруппа).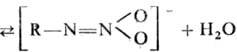
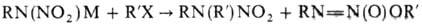
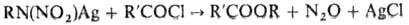
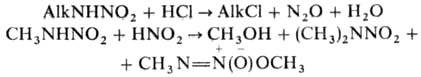
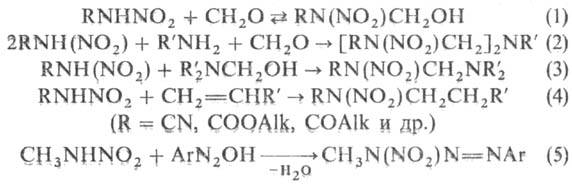
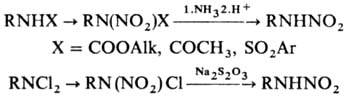
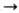 RRNNO2, либо прямым нитрованием вторичных малоосновных аминов смесью
HNO3 и (СН3СО)2О или более основных аминов
смесью HNO3, (СН3СО)2О и НСl.
RRNNO2, либо прямым нитрованием вторичных малоосновных аминов смесью
HNO3 и (СН3СО)2О или более основных аминов
смесью HNO3, (СН3СО)2О и НСl.