Химическая энциклопедия
"НИОБИЙ"
Главная - Химическая энциклопедия - буква Н - НИОБИЙ
НИОБИЙ
(от имени
Ниобы- дочери Тантала в др.-греч. мифологии; лат. Niobium) Nb, хим. элемент
V гр. периодич. системы, ат. н. 41, ат. м. 92,9064. В природе один стабильный
изотоп 93Nb. Поперечное сечение захвата тепловыx нейтронов 1,15.10-28
м2. Конфигурация внеш. электронных оболочек атома 4s24p64d45s1;
степени окисления + 5, реже + 4, + 3, + 2 и + 1; энергии ионизации
при последоват. переходе от Nb0 к Nb7+ равны соотв. 6,882,
14,320, 25,05, 38,3, 50,6, 103 и 124,6 эВ; сродство к электрону 1,13 эВ; работа
выхода электрона 4,01 эВ; электроотрицательность по Полингу 1,6; атомный радиус
0,145 нм, ионные радиусы (в скобках указано координац. число) Nb2+
0,085 нм (6), Nb3+ 0,086 нм (6), Nb4+ 0,082 нм (6), 0,092
нм (8), Nb5 + 0,062 нм (4), 0,078 нм (6), 0,083 нм (7),
0,088 нм (8). Содержание в земной коре
2.10-3% по массе. Встречается в природе обычно вместе
с Та. Наиб. важные минералы -колумбит-танталит, пирохлор и лопарит. Колумбит-танталит
(Fe,Mn)(Nb,Ta)2O6 содержит 82-86% оксидов Nb и Та. При
содержании Н. выше, чем Та, минерал наз. колумбитом, при обратном соотношении
- танталитом. Пирохлор (Na,Ca,Ce)2(Nb,Ti)2(OH,F)O6
обычно содержит 37,5-65,6% Nb2O5; лопарит (Na,Ce,Ca,SrXNb,Ti)O3-8-10%
Nb2O5. Минералы Н. слабо парамагнитны и радиоактивны из-за
примесей U и Th. Колумбит встречается в
изверженных пегматитах, биотитах и щелочных гранитах, иногда-в россыпных месторождениях
(Нигерия), его часто добывают как побочный продукт обогащения оловянных концентратов.
Пирохлор содержится в карбонатитах, щелочных породах (Канада), нефелин-сиенитовых
пегматитах, в элювиальных продуктах выветривания сиенито-карбонатитов (Бразилия).
Крупные залежи лопарита имеются в СССР. Общие мировые запасы Н.
(без СССР) оценивались (1980) в 18 млн. т, в пром. месторождениях-ок. 3,4 млн.
т (из них 3,2 млн.т в Бразилии). Свойства. Н.-блестящий
серебристо-серый металл; кри-сталлич. решетка объемноцентрир. кубическая типа
a-Fe, а = 0,3294 нм, z = 2, пространств. группа Im3m;
т. пл. 2477 °С, т. кип. ок. 4760 °С; плотн. 8,57 г/см3; С0р 24,44Дж/(моль.К); DH0пл 31,0
кДж/моль (2477 °С), DH0возг 720кДж/моль (0
К), DH0исп 662 кДж/моль (4760 °С); S0298
36,27 ДжДмоль•К); ур-ние температурной зависимости давления пара над жидким
Н.: lgр(Па) = 13,877-40169/T (2304 <= Т<= 2596
К); температурный коэф. линейного расширения 7,1.10-6К-1
(0-100 °С); теплопроводность 52,3 Вт/(м.К) при 20 °С и 65,2
Вт/(м.К) при 600 °С; r 1,522.10-9 Ом.м
при 0°С, температурный коэф. r 3,95 х х 10-3 К-1 (0-100°С).
Н. парамагнитен, уд. магн. восприимчивость + 2,28.10-6
(18 °С). Т-ра перехода в сверхпрово-дящее состояние 9,28 К. Чистый Н. легко обрабатывается
давлением на холоду; жаропрочен; sраст 342 МПа (20 °С) и 312
МПа (800 °С); относит. удлинение 19,2% (20 °С) и 20,7% (800 °С);
твердость по Бринеллю 450 МПа для чистого металла и 750-1800 МПа для технического.
Примеси H,N,C и О снижают пластичность Н. и повышают его твердость. В хрупкое
состояние Н. переходит при т-рах от — 100 до — 200°С. Химически Н. довольно устойчив.
В компактном виде начинает окисляться на воздухе выше 200 °С, давая ниобия оксиды
, взаимод. с Сl2 выше 200 °С, с F2 и Н2-выше
250 °С (интенсивно с Н2-при 360 °C), с N2-вышe
400 °С, с С и углеводородами-при 1200-1600 °С. На холоду не раств. в
царской водке, соляной и серной к-тах, не реагирует с HNO3, Н3РО4,
НСlО4, водным р-ром NH3. Устойчив к расплавл. Li, Na,
К, Sn, Pb, Bi, а также Hg. Раств. во фтористоводородной к-те, ее смесях с HNO3,
в расплавл. NH4HF2 и NaOH. Обратимо поглощает Н2,
образуя твердый р-р внедрения (до 10 ат. % Н) и гидрид состава NbHx
(x = 0,7-1,0) с ромбич. кристаллич. решеткой; для NbH0,761
DH0обр — 74,0 кДж/моль; р-римость водорода в Н.
меняется от 104 см3/г при 20 °С до 4,0 см3/г при 900
°С, выше 1000 °С Н2 практически не раств. в Н. Гидриды образуются
также на первых стадиях растворения Н. во фтористоводородной к-те,
ее смеси с HNO3 и расплаве NH4HF2, а также
при электролизе к-т с катодом из Н. (таким путем получен NbH2,00).
Гидрирование Н. и дегидрирование при нагр. используют для получения мелкодисперсного
металла. При взаимодействии Н. с
С образуется одна из трех фаз: твердый р-р С в металле, Nb2C или
NbC. Твердый р-р содержит 2 ат. % С при 2000 °С; р-римость С в Н. резко
падает с понижением т-ры. К а р б и д Nb2C образует три полиморфные
модификации: до 1230 °С устойчива ромбич. a-фаза (пространств. группа Pbcn),
при 1230°С она превращ. в гексагoн. b-фазу (пространств. группа Р6322),
к-рая при 2450 °С переходит в др. гексагoн. -g-фазу (пространств. группа
P63/mmc); т. пл. ок. 2990 °С (инконгруэнтно, с
выделением твердого NbСx). Для a-Nb2C: C0p
63,51 Дж/(моль.К); DH0обр - 188 кДж/моль;
S0298 64,10 ДжДмоль.К); т-ра перехода
в сверхпроводящее состояние 9,2 К. Карбид NbC-кристаллы серого или серо-коричневого
цвета, область гомогенности от NbC0,70 до NbC1,0; при
377 °С наблюдается полиморфный переход, высокотемпературная кубич. фаза
(а = 0,4458 нм, пространств. группа Рт3т, плотн. 7,81 г/см3)
инконгруэнтно плавится ок. 3390 °С; DH0обр-
135 кДж/моль; S0298 35,4 ДжДмоль•К); т-ра перехода
в сверхпроводящее состояние 12,1 К. Фаза NbC0,80 имеет т. пл. ~ 3620
°С. NbC образует твердые р-ры с ТаС, TiC, ZrC и др. В пром-сти NbC получают
взаимод. Nb2O5 с сажей ок. 1800 °С в атмосфере Н2;
м.б. также получен из элементов или нагреванием летучих галогенидов Н. в атмосфере
углеводородов до 2300-2900 °С. В системе Nb-N образуются:
твердый р-р внедрения азота в Н. (a-фаза), н и т р и д ы Nb2N (гексагон.
р-фа-за) и NbN (кубич. d- и гексагон. q-фазы) и еще неск. фаз. Р-римость N2
в Н. при атм. давлении описывается ур-нием с = 180ехр(- 57300/RT)
ат. % (1073 <= T<= 1873 К). b-Фаза гомогенна в области NbN0,4-NbN0,5;
для нее а = 0,3056 нм с = 0,4995 нм, пространств. группа Р63/ттс- С0p 67 ДжДмоль.К); DH0обр
- 249 кДж/моль; S0298 79 ДжДмоль.К).
Светло-серая с желтоватым блеском d-фаза гомогенна в области NbN0,88-NbNl,06,
для нее а = 0,4373-0,4397 нм, пространств. группа Fm3m.
Для q-фа-зы: С0р 37,5 ДжДмоль.К),
DH0oбр -234 кДж/моль, S0298
33,3 ДжДмоль•К). Нитриды не раств. в соляной к-те, HNO3 и H2SO4,
при кипячении со щелочами выделяют NH3, при нагр. на воздухе окисляются.
Т-ры перехода в сверхпроводящее состояние для NbNx с x
= 0,80, 0,90, 0,93 и 1,00 равны соотв. 13,8, 16,0, 16,3 и 16,05 К. Нитриды получают
нагреванием металла или гидрида Н. в атмосфере N2 или NH3
до 1100-1800 °С или взаимод. летучих галогенидов Н. с NH3. Известны
карбо- (получают взаимод. Nb, N2 или NH3 с углеводородами
выше 1200°С) и оксинитриды Н. С фосфором Н. образуют
ф о с ф и д ы NbP и NbP2, с As-а р с е н и д ы NbAs и NbAs2,
с Sb-а н т и м о н и д ы Nb3Sb, Nb5Sb4, NbSb2,
с S-с у л ь ф и д ы NbS3, NbS2 и NbS. С т а н-н и д Nb3Sn
(т.пл. ~2130°С) и г е р м а н и д Nb3Ge (т. пл. ~ 1970 °С)-
сверхпроводники с т-рами перехода в сверхпроводящее состояние соотв. 18,05 К
и 23,2 К; получают их из простых в-в. Н. образует бесцв. с у
л ь ф а т ы. Nb2O4SO4-кристаллы с плотн. 3,6
г/см3; при 600-650 °С разлагается до Nb2O5;
получают взаимод. Nb2O5 с 92,5%-ной H2SO4
в запаянных сосудах при 250-300 °С. Nb2O3(SO4)2-кристаллы
с тетрагон. решеткой (а = 1,50 нм, с = 1,40 нм, z = 16, плотн.
3,42 г/см3); при нагр. разлагается до Nb2O4SO4;
раств. в воде, причем р-римость растет с увеличением концентрации H2SO4
и достигает 4,60% по массе (в расчете на Nb2O5) при 20
°С и концентрации SO3 76,68% по массе; получают нагреванием Nb2O5
с избытком конц. H2SO4 до 300-350 °С. См. также Ниобаты
, Ниобийорганические соединения
. Получение. Ок. 95%
Н. получают из пирохлоровых, тан-талит-колумбитовых и лопаритовых руд. Руды
обогащают гравитац. методами и флотацией, а также электромагн. или радиометрич.
сепарацией, выделяя пирохлоровые и колум-битовые концентраты с содержанием Nb2O5
до 60%. Концентраты перерабатывают
до феррониобия или техн. Nb2O5, реже-до NbCl5
и K2NbF7 (см. Ниобия галогениды
). Металлический
Н. получают из Nb2O5, K2NbF7 или
NbCl5. При произ-ве феррониобия
смесь пирохлоровых концентратов с гематитом Fe2O3, порошкообразным
Аl и добавками флюса загружают в вертикальные водоохлаждаемые стальные или медные
реакторы и с помощью спец. запала инициируют экзотермич. р-ции: 3Nb2O5
+ 10Al Техн. Nb2O5
получают выщелачиванием Nb и Та из концентратов и шлаков оловянной плавки действием
фтористоводородной к-ты с послед. очисткой и разделением Nb и Та экстракцией
100%-ным трибутилфосфатом, циклогекса-ноном, метилизобутилкетоном (реже-др.
экстрагентами), реэкстракцией Н. действием водного р-ра NH4F, осаждением
из реэкстракта гидроксида Nb, его сушкой и прокаливанием. По сульфатному способу
концентраты обрабатывают H2SO4 или ее смесью с (NH4)2SO4
при 150-300 °С, выщелачивают р-римые сульфаты водой, отделяют Nb и Та от
Ti, разделяют и очищают Nb и Та экстракцией их фторидных или оксофторидных комплексов,
выделяя затем Nb2O5. Хлоридный способ предусматривает
смешивание концентрата с коксом, брикетирование и хлорирование брикетов в шахтной
печи при 700-800 °С или хлорирование непосредственно порошкообразного концентрата
и кокса в солевом хлоридном расплаве на основе NaCl и КСl. Далее проводят отделение
летучих хлоридов Nb и Та, их разделение и очистку ректификацией и раздельный
гидролиз водой с прокаливанием осадка гидроксида Н. Иногда хлорируют феррониобий
или отходы металла. Восстанавливают Nb2O5
до металла алюмино- или карбо-термически либо нагреванием смеси Nb2O5
и NbC при 1800-1900 °С в вакууме. Применяют также натриетермич. восстановление
K2NbF7, электролитич. восстановление Nb2O5
или K2NbF7 в расплаве K2NbF7 и хлоридов
щелочных металлов. Особо чистый металл или покрытия из Н. на др. металлах получают
восстановлением NbCl5 водородом при т-рах выше 1000°С. Порошкообразный Н. брикетируют,
спекают штабики и переплавляют их в вакууме в электродуговых или электроннолучевых
печах. На начальных стадиях очистки применяют также электролиз с расходуемым
электродом в расплаве KCl-NaCl. Описаны способы переработки
концентратов Н. с использованием жидких и газообразных фторирующих реагентов. Определение. Н.
определяют гравиметрически с использованием в качестве осадителей таннина, купферона,
8-гидро-ксихинолина и др. с послед. прокаливанием до Nb2O5.
Применяют также колориметрич. (с добавлением в исследуемый р-р Н2О2,
KSCN или соляной к-ты), радиометрич. (по 95Nb) и разл. спектральные
методы. Для перевода соединений Н. в р-р используют фтористоводородную к-ту
или сплавляют с NaHSO4 либо K2S2O7
(реже-с К2СО3, КОН), выщелачивая затем плав насыщ. р-ром
(NH4)2C2O4 в 20%-ном р-ре винной
к-ты. Др. элементы отделяют от Н. осаждением их сульфидов при действии H2S
или (NH4)2S; титан отделяют в виде титанилсалициловой
к-ты или жидкостной экстракцией. Применение. Ок.
40-50% производимого Н. используют для микролегирования сталей (концентрация
Н. 0,05-0,10% по массе), 20-30%-при получении нержавеющих и жаростойких сталей
(0,2-1,2% Н.), 20-25%-при получении жаропрочных сплавов на основе Ni или Fe
(1-5% Н.), 1-3%-в виде металла и сплавов на основе ниобия. Н. и сплавы на его
основе находят ограниченное применение в соплах ракет и ядерных реакторах. В
электронике порошкообразный Н.-заменитель Та в электролитич. конденсаторах.
См. также Ниобия сплавы
. Карбид Н.-промежут. продукт
при получении Н. или NbCl5, материал высокотемпературных нагревателей,
в конструкциях высокотемпературных газоохлаждаемых ядерных реакторов, вместе
с карбидами Та и Ti-компонент твердых сплавов на основе WC и Со. Нитрид NbN
применяют для изготовления сверхпроводящих болометров, мишеней передающих телевизионных
трубок. Карбонитрид NbC0,25N0,75 используют при изготовлении
сверхпроводящих квантовых интерференц. устройств, высокочастотных резонаторов
с высокими значениями добротности; перспективен для использования в магн. системах
реакторов термоядерного синтеза. Металлиды Nb3Sn и Nb3Ge
применяют при изготовлении соленоидов сверхпроводящих устройств; Nb3Ge
перспективен для использования в магнитах МГД-генерато-ров и др. электротехн.
устройств. См. также Лития ниобат
. Мировое произ-во (без СССР,
1980) Н. в виде металла и сплавов ок. 15 тыс. т, в т.ч. 0,4 тыс. т-из шлаков
оловянной плавки. Н. открыл в 1801 Ч. Хатчет
и назвал его "колумбием", заново Н. открыт в 1845 Г. Розе. Идентичность
Колумбия и Н. была доказана позднее. ПДК Н. в воде 0,01 мг/л,
для нитрида Н. в воздухе рабочей зоны 10 мг/м3. Лит.: Горощенко Я. Г., Химия ниобия и тантала, К., 1965; Киффер Р., Браун X., Ванадий, ниобий, тантал, пер. с нем., М., 1968; Фейрбротер Ф., Химия ниобия и тантала, пер. с англ., М., 1972; Берлин И. К., Вайсен-берг А. И., в кн.: Металлургия цветных и редких металлов, т. 10, М., 1977, с. 37 72; Патрикеев Ю. Б., Воробьева Н.С., Зайцев А. Б., "Цветная металлургия", 1985, № 3, с. 90-92; Gupta С. К., "International Metals Reviews", 1984, v. 29, № 6, p. 405-44. Э. Г. Раков, В. А. Мусорин.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: НИОБИЙ
будет выглядеть так: Что такое НИОБИЙ
 6Nb + + 5Аl2О3; Fe2O3 + 2Аl
6Nb + + 5Аl2О3; Fe2O3 + 2Аl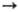 2Fe
+ Al2O3. Затем сливают шлак, охлаждают и измельчают полученный
сплав. Выход Н. в слиток при массе загрузки концентрата до 18 т достигает 98%.
2Fe
+ Al2O3. Затем сливают шлак, охлаждают и измельчают полученный
сплав. Выход Н. в слиток при массе загрузки концентрата до 18 т достигает 98%.