Химическая энциклопедия
"НАТРИЯ БОРАТЫ"
Главная - Химическая энциклопедия - буква Н - НАТРИЯ БОРАТЫ
НАТРИЯ БОРАТЫ
, натриевые
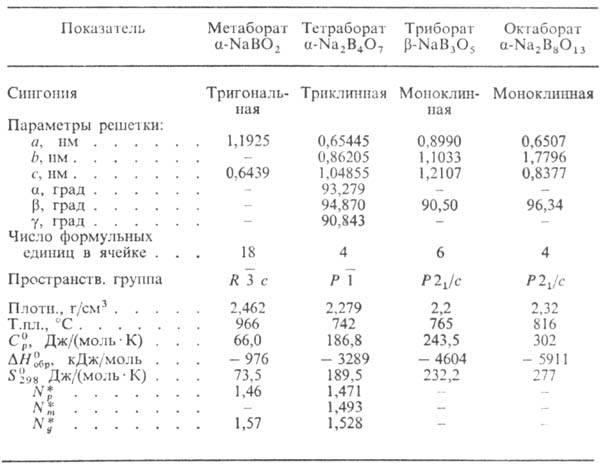
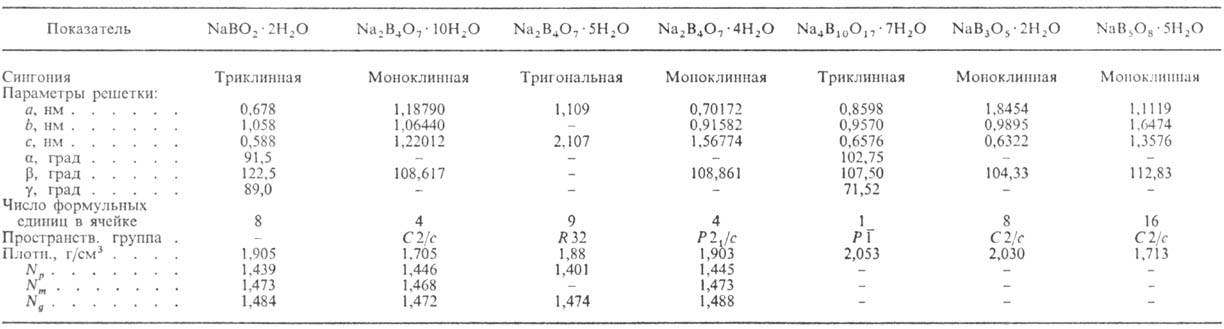
соли к-т бора. Св-ва безводных Н.б. и их гидратов приведены соотв. в табл. 1
и 2. Среди безводных Н.б. известны также Na3BO3, Na4B2O5,
Na6B4O9 и др., среди гидратов-Na2B5O7(OH)3.2H2O
(минерал эцкуррит), Na2B5O8 (ОН).2Н2O
(минерал насинит), Na4B10O16(OH)2.2Н2О
(минерал бирингучит) и др. Д е к а г и д р а т т е
т р а б о р а т а н а т р и я Na2B4O7 x х 10Н2О
(минерал бура, или тинкал) имеет строение Na2 [В4О5(ОН)4].8Н2О;
в сухом воздухе постепенно выветривается; т. пл. 60,8 °С (инконгруэнтно,
с образованием тетрагидрата). При нагр. на воздухе декагидрат переходит в метастабильный
п е н т а г и д р а т Na2B4O7.5H2O
(минерал тинкалконит), имеющий строение Na2 [B4O5(OH)4]
x х 3Н2О; гигроскопичен; при поглощении влаги из воздуха превращ.
в декагидрат, при нагр. до 136°С-в тетра-гидрат Na2B4O7.4H2O
(минерал кернит). Тетрагидрат имеет строение Na, [В4О6(ОН)2].3Н2О;
из водных р-ров кристаллизуется выше ~60°С. При нагр. до 161 °С тетрагидрат
превращ. в д и г и д р а т (минерал метакернит), имеющий строение Na2
[В4О5 (ОН)4], при 260 °С- в аморфный м
о н о г и д р а т, при 380 °С полностью обезвоживается, давая безводный
стеклообразный Na2B4O7, к-рый постепенно кристаллизуется. Т е т р а б о р а т Na2B4O7
имеет метастабильные b (ромбическая) и g (моноклинная) модификации с т. пл.
соотв. 664 и 710 °С; т. кип. 1575 °С (пары обеднены В2О3);
при охлаждении расплав легко образует стекла с плотн. 2,36 г/см3;
в присут. паров воды испаряется в виде NaBO2 + НВО2; расплав
легко растворяет оксиды металлов; гигроскопичен, р-римость в воде 3,1% (25 °С),
9,5% (50 °С). Водные р-ры Na2B4O7 обладают
буферными св-вами. Р-римость Na2B4O7 при 25
oС в этаноле-0,05%, ацетоне-0,006%, не раств. в диэтиловом эфире,
глицерине, в метаноле раств. с образованием борорг. соединений. Получают Na2B4O7.10Н2О
перекристаллизацией прир. буры или кернита, взаимод. прир. боратов - боронатрокаль-цита,
ашарита и т.п. (см. Бораты неорганические)-с Na2CO3
и NaHCO3 при нагр., действием Na2CO3
на Н3ВО3, СО2 на р-р NaBO2. Бура-сырье
для получения Н3ВО3 и др. соед. В; компонент флюсов для
сварки и пайки металлов, шихты для глазурей, эмалей, стекла и керамики, моющих
ср-в, электролитов для осаждения Ni и др. металлов; протрава при крашении, антисептик,
консервирующее ср-во для обработки кож, пропитки древесины; микрокомпонент удобрений;
реагент при получении гербицидов, ингибиторов коррозии, антифризов, изоляц.
материалов, крахмала и клеев. Мировое произ-во 1,5 млн. т/год (1977). М е т а б о р а т н а т
р и я NaBO2 кристаллизуется из водных р-ров (содержащих небольшой
избыток NaOH) в виде гидратов с 4 (ниже 58 °С) или с 2 (58-112 oС)
молекулами воды; в интервале от 112°С до т-ры кипения насыщ. р-ра (120,2
°С) кристаллизуется NaBO2.0,5H2O, к-рый
обезвоживается при 306 °С. Известны также моногидрат и гидрат Na3[B3O5(OH)2].
Т е т р а г и д р а т NaBO2.4H2O образует кристаллы
триклинной сингонии с плотн. 1,743 г/см3; Np = 1,443,
Nm = 1,467, Ng = 1,480. Для безводного NaBO2
известна также метастабильная модификация с т. пл. 934 °С; испаряется
без разложения; т. кип. 1434°С; р-римость в воде 20,2% (20 °С), 39%
(60 °С), 55% (100 °С), легко образует пересыщ. р-ры; не гигроскопичен;
р-римость в этиленглико-ле 6,98% (25 °С), в этаноле и эфире не растворяется.
Получают NaBO2.4H2O действием NaOH на Na2B4O7
или Na2CO3 на Са(ВО2)2. Используют
как исходное в-во для получения пербората Na и др. соед. В, боросиликатных стекол,
как компонент гербицидов и антифризов. Гидраты Na2B4O7
и NaBO2, а также вяжущие материалы из них перспективны для защиты
от нейтронного излучения. Табл. 1.-ХАРАКТЕРИСТИКА
БЕЗВОДНЫХ БОРАТОВ НАТРИЯ * Np,
Nm и Ng-соотв. меньший, средний и больший показатели
преломления. Табл. 2.-ХАРАКТЕРИСТИКА
КРИСТАЛЛОГИДРАТОВ БОРАТОВ НАТРИЯ П е н т а б о р а т NaB5O8
кристаллизуется из водных р-ров в виде п е н т а г и д р а т а (минерал сборгит),
имеющего строение Na [B5O6 (ОН)4]•3Н2О;
при нагр. в водном р-ре он превращ. при 106°С в т е т р а г и д р а т, а
при нагр. на воздухе при 117°С-в д и г и д р а т. Последний при 308°С
переходит в м о н о г и д р а т, к-рый обезвоживается при 350 °С; р-римость
пентабората в воде (для безводной соли) 10,6% (20 °С), 21,8% (50 °С),
50,3% (100 °С); т. кип. насыщ. р-ра 109,6 °С; не раств. в спирте. Получают
NaB5O8.5H2O взаимод. Na2B4O7
с В2О3 или Н3ВО3 или бората Са с
Na2CO3 и СО2. Используют для получения др.
соед. В, как дефолиант для хлопка, гербицид, пропитку для огнестойких тканей,
микрокомпонент удобрений. Лит.: Ткачев К.
В., П лышевский Ю. С., Технология неорганических соединений бора, Л., 1983.
П. И. Федоров. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: НАТРИЯ БОРАТЫ
будет выглядеть так: Что такое НАТРИЯ БОРАТЫ