Химическая энциклопедия
"МЫШЬЯКА ОКСИДЫ"
Главная - Химическая энциклопедия - буква М - МЫШЬЯКА ОКСИДЫ
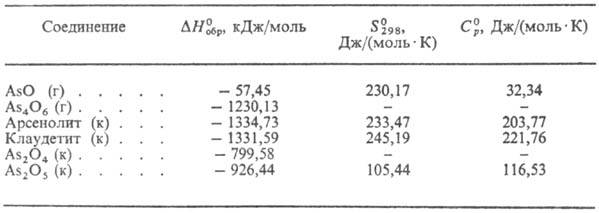
МЫШЬЯКА ОКСИДЫ . Устойчивые формы М.о. в газовой фазе-сесквиоксид (мышьяковистый ангидрид) As2O3 и его димер As4O6. До 300 °С осн. форма в газовой фазе-димер, выше этой т-ры он заметно диссоциирован, а при т-рах выше 1800 °С газообразный оксид состоит практически из мономерных молекул As2O3. Т.кип. 461 °С; термоди-намич. св-ва М.о. приведены в табл. 1. Табл. 1.-ТЕРМОДИНАМИЧЕСКИЕ
СВОЙСТВА ОКСИДОВ МЫШЬЯКА Примечание: г-газ, к-кристалл. Газообразная смесь As4O6
и As2O3 образуется при горении As в кислороде, при окислит.
обжиге сульфидных минералов As, напр. арсенопирита, руд цветных металлов и полиметаллич.
руд. При конденсации пара As?O3(As4O6)
выше 310 °С образуется стекловидная форма As2O3; плотн.
3,74 г/см3; р-ри-мость 1,82 г в 100 г воды при 25 °С. При конденсации
пара ниже 310°С образуется бесцв. поликристаллич. кубич. модификация (а = 1,1075 им, z = 8, пространств. группа Fd3m); т.пл.
278 °С; плотн. 3,87 г/см3; р-римость 2,05 г в 100 г воды при
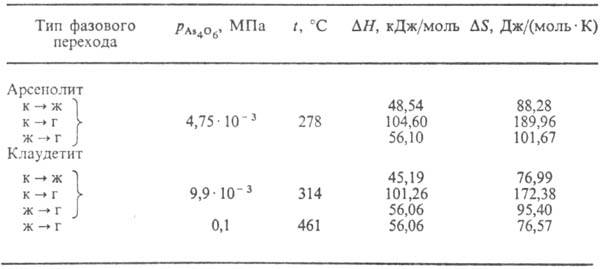
25 °С; в природе-минерал арсенолит (см. также табл. 2). Арсенолит устойчив
ниже - 13°С, ок. 221 -223 °С очень медленно начинает превращаться в
моноклинную модификацию (а = 0,5339 нм, b = 1,2984 нм, с =
0,45405 нм, b = = 94,27°, z = 4, пространств. группа Р21/n);
т.пл. 314 °С; плотн. 4,15 г/см3; р-римость 2,1 г в 100 г воды
при 25 °С; в природе - минерал клаудетит. Все формы As2O3
хорошо раств. в к-тах и щелочах. Табл. 2.-ФАЗОВЫЕ ПРЕВРАЩЕНИЯ
As4O6(As2O3) Примечание: г-газ, ж-жидкость,
к-кристалл. О к с и д As(V) (мышьяковый
ангидрид) As2O5-бесцв. кристаллы ромбич. сингонии (а = 0,8454 нм, b = 0,8645 нм, с = 0,4629 нм, z = 4,
пространств. группа P212121); плотн.
4,1 г/см3; р-римость 65,8 г в 100 г воды при 25 °С. При нагр.
As2O5 диссоциирует на As4O6 (газ)
и О2; при 730 °С суммарное давление диссоциации 0,1 МПа. Получают
As2O5 обезвоживанием конц. р-ров H3AsO4
с послед, прокаливанием образующихся гидратов; вначале кристаллизуется тетрагид-рат
As2O5.4H2O (DH0обр
—2115,48 кДж/моль), при последю обезвоживании-соед. состава 3As2O5.5H2O
(DH0обр - 4279,08 кДж/моль), выше 120 °С-безводный
As2O5. Известен оксид As2O4, получаемый
спеканием As2O3 и As2O5 при 280
°С в присут. паров воды; бесцв. кристаллы ромбич. сингонии (а = 0,8566
нм, b = 0,7271 нм, с = 0,5236 нм, z = 4, пространств. группа
Рпат); выше 500 °С диспропорцио-нирует на As2O3
и As2O5. Известен также газообразный м о н о о к с и д
AsO, образующийся при электрич. разряде в парах триоксида As при пониженном
давлении. При растворении в воде
As2O3 образует существующие только в р-ре о р т о м ы
ш ь я к о в и с т у ю H3AsO3, или
As(OH)3, и м е т а м ы ш ь я к о в и с т у ю HAsO2, или
AsO(OH), к-ты; обладают амфотерными, преим. кислыми,
св-вами. Для H3AsO3: DH0обр
для бесконечно разб. р-ра — 747,36 кДж/моль; при 25°С K1
= 7,9.10-9, К2 = 7,9.10-13,
К3 = 4,0.10-14. При растворении As2O5
в воде образуется о р т о м ы ш ь я-к о в а я к-т а Н3 AsO4;
DH0обр для бесконечно разб. водного р-ра - 909,29
кДж/моль; К1 = 6,3.10-3, К2
= 1,0.10-7, К3 = = 3,2.10-12;
получают обычно окислением As или As2O3 конц. HNO3.
Предполагается существование п и р о м ы ш ь я-к о в и с т о й к-т ы H4As2O5.
Соли кислородсодержащих к-т As наз. а р с е н а т а м и. Сесквиоксид As2O3
-исходное в-во для получения As и его соед.; его используют как консервирующее
ср-во при выделке мехов и кож, в произ-ве оптич. стекол, как инсектицид, в аналит.
химии для приготовления эталонных р-ров мышьяка, как некротизирующее лек. ср-во.
Оксид As2O5 применяют как гербицид, антисептик для пропитки
древесины. Оксиды As входят в состав образующихся на пов-сти полупроводниковых
соед. AIIIBV (GaAs, In As и др.) тонких ок-сидных пленок,
определяющих электрофиз. параметры интегральных устройств на основе этих полупроводников. М.о. токсичны; ПДК 0,3
мг/м3, доза As2O3 менее 0,1 г при попадании
в желудок смертельна для человека. B. И. Белый
. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: МЫШЬЯКА ОКСИДЫ
будет выглядеть так: Что такое МЫШЬЯКА ОКСИДЫ