Химическая энциклопедия
"МОЧЕВАЯ КИСЛОТА"
Главная - Химическая энциклопедия - буква М - МОЧЕВАЯ КИСЛОТА
МОЧЕВАЯ КИСЛОТА
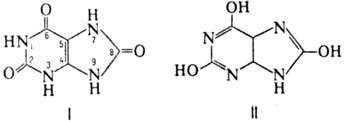
(пурин-2,6,8-трион),
ф-ла I, мол. м. 168,12; бесцв. кристаллы; т.разл. 400 °С; DH0cгор
-1919 кДж/моль; плохо раств. в воде, этаноле, диэтиловом эфире, раств. в разб.
р-рах щелочей, горячей H2SO4, глицерине. В р-ре существует
в таутомерном равновесии с гидроксифор-мой (ф-ла II), при этом преобладает оксо-форма. М. к.-двухосновная к-та
(рКа 5,75 и 10,3), образует кислые и средние соли (ураты).
Под действием едких щелочей и конц. к-т разлагается на НСl, NH3,
CO2 и глицин. Легко алкилируется сначала по N-9, затем по N-3 и N-1.
В гидроксиформе вступает в р-ции нуклеоф. замещения; напр., с РОСl3
образует 2,6,8-трихлорпурин. Состав продуктов окисления М.к. зависит от условий
р-ции; под действием HNO3 образуются аллоксантин (III) и аллоксан
(IV), при окислении
нейтральным или щелочным р-ром КМnО4, а также р-рами РbО2
и Н2О2- сначала аллантоин (V),
затем гидантоин (VI) и парабановая к-та (VII). Аллоксантин с NH, дает мурексид
,
к-рый используют для идентификации М.к. М.к.-продукт азотистого
обмена в организме животных и человека. Содержится в тканях (мозг, печень, кровь)
и поте млекопитающих. Нормальное содержание в 100 мл крови человека 2-6 мг.
Мононатриевая соль-составная часть камней мочевого пузыря. Высохшие экскременты
птиц (гуано) содержат до 25% М.к. и служат источником ее получения. Методы синтеза:
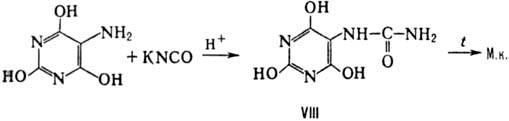
1) конденсация урамила (аминобарбиту-ровой к-ты) с изоцианатами, изотиоцианатами
или ци-анатом К через образование псевдомочевой к-ты (VIII), напр.: 2) конденсация мочевины
с цианоуксусным эфиром с послед. изомеризацией образующейся цианоацетилмочевины
в ура-мил, из к-рого по первому способу получают М.к. М.к.-исходное в-во для
получения аллантоина, аллокса-на, парабановой к-ты, кофеина; компонент косметич.
кремов; ингибитор коррозии; агент, способствующий равномерному прокрашиванию
волокон и тканей. Лит.: Иванский В.
И., Химия гетероциклических соединений, М., 1978, с. 432-34; Гауптман 3., Грефе
Ю., Ремане X., Органическая химия, пер. с нем., М., 1979, с. 601-02; Kirk-Othmer
encyclopedia, 3 ed., v. 23, N.Y., 1983, p. 608-13. И. В. Хвостов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: МОЧЕВАЯ КИСЛОТА
будет выглядеть так: Что такое МОЧЕВАЯ КИСЛОТА