Химическая энциклопедия
"МИОГЛОБИН"
Главная - Химическая энциклопедия - буква М - МИОГЛОБИН
МИОГЛОБИН
(от греч.
mys, род. падеж myos- мышца и лат. globus-шар), белок мышц позвоночных животных
и человека, связывающий переносимый гемоглобином О2 и передающий
его окислит. системам клетки. Состоит из одной полипептидной
цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в
плотную глобулу размером 4,5 х 2,5 нм. В спец. полости М. ("кармане")
помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине
.
Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали
правозакрученные). Между областями спи-рализации находятся 5 неспирализованных
участков; такие же участки находятся на концах цепи. Внутр. область молекулы
состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина
и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина,
аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как
полярные, так и неполярные аминокислотные остатки. Атом железа тема может
находиться в 4 состояниях: в физиологически активном пентакоординир. высокоспиновом
ферросостоянии (дезоксимиоглобин, Fe2 + , спиновое число
2), в гексакоординир. высокоспиновом феррисостоя-нии (метмиоглобин, Fe3
+ , 6-й лиганд Н2О, спиновое число 5/2)
и в низкоспиновых ферро- и феррисостояниях (соотв. Fe2+ и
Fe3+ , спиновое число О и 1/2). Низкоспиновые
формы образуются из высокоспиновых при взаимод. атома железа тема с нек-рыми
лигандами (у дезоксимиоглобина с О2, СО, NO и др.; у метмиоглобина
с CN-, N-3 и ими-дазолом). Для феррисостояния
возможна смесь высокоспиновой и низкоспиновой форм (лиганды ОН-,
NO-2, NCS-). Связывание лигандов сопровождается
конформац. изменениями белка, и, наоборот, конформац. изменения вблизи тема
изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац.
взаимод.). Ф-ция М. запасать О2 в мышцах при его избытке и освобождать
при недостатке основана на способности иона Fe2+ обратимо связывать
молекулу О2 с образованием оксимио-глобина. Высвобождение из оксимиоглобина
молекулы О2, необходимого работающей мышце, происходит в момент сокращения
последней, когда в результате сжатия капилляров парциальное давление О2
резко падает. Белок выполняет роль водорастворимого носителя тема, предохраняет
Fe2+ от окисления при его взаимод. с О2 и регулирует величину
сродства к О2. При одном и том же теме и способе его связывания
с белком константа равновесия р-ции оксимио-глобин В больших кол-вах М. содержится
в мышцах морских млекопитающих-дельфинов и тюленей (соотв. 3,5 и 7,7% от массы
тела). М. кашалота был первым
белком, для к-рого Дж. Кендрю с сотрудниками в 1957-60 определили пространств.
структуру молекулы методом рентгеноструктурного анализа. Лит.: Страйер Л.,
Биохимия, пер. с англ., т. 1, М., 1984, с. 48-67; Kendrew J., Dickerson
R., Strandberg В., "Nature", 1960, v. 185, p. 422-27; Antonini E.,
Brunori M., Hemoglobin and myoglobin in their reactions with ligands, Amst.-L.,
1971; Perutz M., "British Medical Bulletin", 1976, v. 32, № 3, p.
195-208. Ю. А. Шаронов. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: МИОГЛОБИН
будет выглядеть так: Что такое МИОГЛОБИН
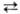 дезоксимиоглобин
+ О2 для М. из разных организмов изменяется в пределах от
0,2.106 до 2,2.106 М-1 (давление
О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин
обладает также слабыми пероксидазной и каталазной активностями.
дезоксимиоглобин
+ О2 для М. из разных организмов изменяется в пределах от
0,2.106 до 2,2.106 М-1 (давление
О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин
обладает также слабыми пероксидазной и каталазной активностями.