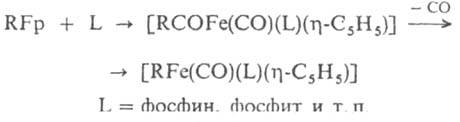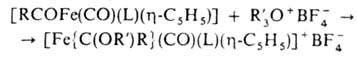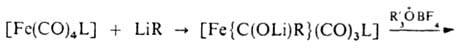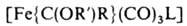ЖЕЛЕЗООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
, содержат связь Fe—С. По типу орг. лиганда и характеру его связи с металлом Ж. с. можно разделить на соед. с s-связью Fe—С, карбеновые, олефиновые, аллильные, диеновые (полиеновые), циклопентадиенильные и ареновые я-комплексы. Такое деление часто условно, поскольку в одной молекуле Ж. с. могут находиться разл. лиганды или лиганд может иметь группировки, разл. образом связанные с одним или неск. атомами Fe. Большинство Ж. с. синтезированы на основе железа карбонилов
[Fe(CO)5], [Fe2(CO)9] и [Fe3(CO)l2] и поэтому содержат СО-лиганды.
Среди Ж. с. наиб. изучены циклопентадиенильные соединения. Среди них особое место занимает ферроцен
[Fe(h-C5H5)2] (о значении символа h см. Гапто-
). Его открытие в 1951 послужило началом бурного развития химии металлоорг. соед. переходных металлов. Для ферроцена характерны хим. св-ва ароматич. соединений. Огромное кол-во его производных получено в результате электроф. замещения в циклопентадиенильных кольцах.
Из др. циклопентадиенильных комплексов наиб. важен [Fe(CO)2(h-C5H5)]2, или Fp2, - устойчивые на воздухе кристаллы. Его получают нагреванием Fe(CO)5 с циклопентадиеном. Исходя из этого димера синтезированы разл. комплексы s- и p-типов.
Железо образует h4-диеновые комплексы с ациклич. и циклич. сопряженными и реже несопряженными диенами,
полиенами и гетеродиенами. Наиб. распространенный тип -[Fе(СО)3(h4-Диен)]. Многие из этих соед. устойчивы, их реакц. способность зависит от природы диена и др. лигандов. Для комплексов с циклич. полиенами характерна стерсохим. нежесткость, обусловленная перемещением групп Fe(CO)3 между разл. атомами кольца. Диеновые и полиeновые комплексы часто претерпевают другие разл. изомeризац. процессы, включающие раскрытие и замыкание кольца с образованием комплексов с бициклич. лигандами. Нск-рые диеновые комплексы присоединяют электрофилы (Н+, СН3СО+ и др.). В результате образуются h3-аллильные соeд., к-рые далее могут превращаться в замещенные диеновые комплексы, напр.:
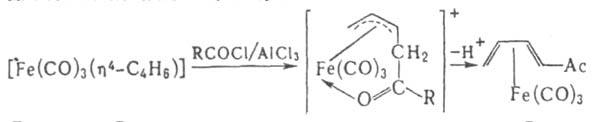
Осн. способ получения этих комплексов - р-ции карбонилов железа с диенами, напр.:
Fe(CO)5 + С4Н6 : [Fе(СО)3(h-С4Н6)]
Для получения комплексов замещенных циклич. диенов применяют взаимод. циклодиенильных катионных комплексов с нуклеофилами, напр.:
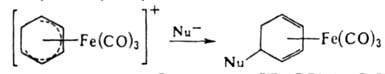
Комплекс железа с циклобутадиеном [Fе(СО)3(h-С4Н4)], в отличие от свободного лиганда, - устойчивое в-во. Для него характерно электроф. замещение:
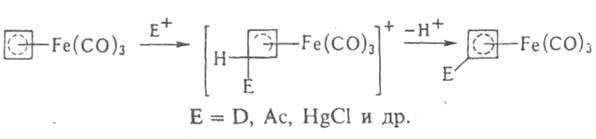
При действии на него окислителей освобождается высокорсакционноспособный циклобутадиен, к-рый используется, напр., для синтеза полициклич. соединений. Известны также Ж. с. с двумя диеновыми лигандами, напр. [Fe(CO)(h-C4H6)2].
Ареновые комплексы имеют меньшее значение. Наиб. изучены катионы [Fе(h5-С5Н5)(h6-арен)]+ , выделенные в виде устойчивых солей с анионами ВF4- , РF6- и др. Они м. б. восстановлены до нейтральных соед. или окислены до дикатионов. Общий метод синтеза этих Ж. с. - замена одного лиганда С5Н5 в ферроцене на арен в присут. Аl-порошка и АlСl3. бис-Ареновые комплексы [Fе(h6-арен)2]2+ получают из FeCl2 и арена в присут. АlСl3. Из Fe и аренов получены крайне неустойчивые [Fе(h6-арен)2].
Осн. типы p-олефиновых комплексов - [Fе(СО)4(h2-олефин)] и [Fр(h2-олефин)]+ . Известны также Ж. с., содержащие две и более молекулы олефина, напр. [Fе(СО)3(h2-СН2 = СНСООСН3)2]. Устойчивость комплексов [Fе(СО)4(h2-олефин)] повышается с ростом электроноакцепторных св-в олефина. При действии на них НСl и НВr расщепляется p-связь Fe - олефин с образованием алканов. Амины, фосфины и др. доноры электронной пары замещают СО или олефин. Для катионных комплексов характерны р-ции с нуклеофилами, напр.:

Комплексы [Fе(СО)4(h2-олефин)] получают нагреванием олефина с [Fe2(CO)9] или его фотохим. р-цией с [Fе(СО)5]; катионные комплексы - замещением Наl- в FpHal на алкен при действии к-т Льюиса (гл. обр. АlСl3), протонированием h1-аллильных и др. b,g-ненасыщенных s-лигандов, а также обменом олефиновых лигандов.
Наиб. распространенные p-аллильные комплексы -[FеНаl(СО)3(h3-аллил)]. Получены также [Fe(СО)(h3-аллил) (h-С5Н5)], [Fе(СО)4(h3-аллил)]ВF4, [Fе(СО)2(h3-аллил)2], а также ряд комплексов, в к-рых аллильная группа входит в состав хелатного лиганда. В [FеНаl(СО)3(h3-аллил)] группы СО м. б. замещены на фосфины. Катионы [Fе(СО)4(h3-аллил)]+ присоединяют нуклеофилы, давая замещенные олефиновые комплексы. Общий метод синтеза комплексов [FеНаl(СО)3 (h3-аллил)] - окислит. присоединение аллилгалогенидов к карбонилам железа. Их также получают присоединением HHal к диеновым комплексам.
Ж. с., содержащие только s-связанные орг. лиганды, напр. [FeR4] (R = норборнил), [Li2Fe(CH3)4], изучены мало; как правило, они крайне неустойчивы. Обычно соед. с s-связью Fе—С содержат стабилизирующие лиганды: h-С5Н5, СО и т. д. В осн. это комплексы типа [s-RFp], где R = алкил, алкенил, алкинил, арил, ацил и др. Их относит. устойчивость возрастает с увеличением электроотрицательности R. Хим. св-ва сильно зависят от характера s-лиганда. Р-ции с электрофилами протекают с сохранением s-связи Fе—С, с существенным изменением характера связи Fе—лиганд или с полным ее разрывом, напр.:

Для них известны также внедрение по s-связи С—Fе: RFp + SO2 : [RSO2Fp], и замещение групп СО, к-рое иногда сопровождается миграцией s-лиганда от Fе к координир. группе СО:
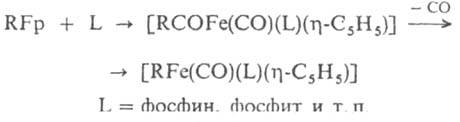
Комплексы RFp получают замещением галогена в орг. галогенидах действием Fр-, а также присоединением нуклеофилов к катионным h2-олефиновым комплексам или обменными р-циями FpI с литий- и магнийорг. соединениями. Менее исследованы s-соед. Fe, не содержащие лиганда С5Н5, напр. [RFFeI(CO)4], где RF - перфорированный алкил (получают окислит. присоединением RFI к Fе(СО)5 или [R2Fe(Ph2PCH2CH2PPh2)2], к-рый синтезируют действием AlR3 на ацетилацетонат Fe(III) в присут. (Ph2PCH2)2.
Осн. типы карбеновых комплексов - [Fe{C(X)(Y)}(CO)(L) (h-С5Н5)]+ и [Fe{C(X)(Y)}(CO)3L], где X, Y-OR, NR2, SR, Н, Alk, Ar; L-CO, PR3, P(OR)3. Комплексы, не содержащие гетероатомных заместителей, неустойчивы. Комплексы 1-го типа получают присоединением электрофилов к ацильному лиганду, напр.:
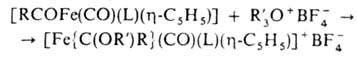
комплексы 2-го типа - по р-ции:
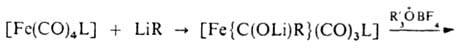
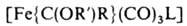
Ж. с. широко используются в процессах изомеризации и гидроформилирования олефинов и полиенов, раскрытия малых циклов, десульфуризации, циклопропанирования, ацилирования диенов и полиенов, в синтезе полициклич. и спироциклич. соед., нек-рых алкалоидов, для стабилизации неустойчивых молекул и др.
Лит.: Никитина Т. В., в кн.: Методы элементоорганической химии. Металлоорганические соединения железа, под общей ред. А. Н. Несмеянова и К. А. Кочешкова, М., 1985; Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 4, N. Y., 1982, p. 243-649. Л. В. Рыбин.
|