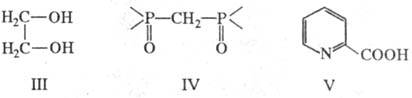Химическая энциклопедия
"ХЕЛАТООБРАЗУЮЩИЕ ИОНООБМЕННЫЕ СМОЛЫ,"
Главная - Химическая энциклопедия - буква Х - ХЕЛАТООБРАЗУЮЩИЕ ИОНООБМЕННЫЕ СМОЛЫ,
ХЕЛАТООБРАЗУЮЩИЕ ИОНООБМЕННЫЕ СМОЛЫ,
селективные ионообменные смолы
, образующие с катионами металлов устойчивые внутрикомплексные соед.-
хелаты. ХЕЛАТЫ (от греч. chele - клешня) (клешневидные соед., хе-латные соед.),
координационные соединения, в к-рых центр, атом (или ион) связан одновременно
с двумя или более донор-ными атомами лиганда, в результате чего замыкается один
или неск. гетероциклов. Лиганды, образующие хелатные циклы, наз. хелатирующими
(хелатообразую-щим и) реагентам и, они должны быть по крайней мере бидентатными.
Замыкание хелатного цикла такими лиганда-миназ. хелатированиемили хелатообразовани-ем. Наиб. обширный и важный
класс X.- хелатные комплексы металлов (металлохелаты). Способность координировать
лиганды присуща металлам всех степеней окисления. Элементы осн. подгрупп в качестве
центр. атомов-комплек-сообразователей обычно выступают лишь в высших степенях
окисления. Хелатирующие реагенты содержат
два осн. типа электро-нодонорных центров: А - группы, содержащие подвижный
протон, напр. — COOH, — ОН, — SO3H, при их координации к центр, иону
возможно замещение протона; Б - нейтральные электронодонорные группы,
напр. R2CO, R3PO, R3N. X., в к-рых при замыкании
хелатного цикла лиганд использует протон-содержащую и нейтральную электронодонорные
группы и формально связан с центральным атомом ковален-тной и донорно-акцепторной
связью, наз. внутрикомп-лексными соединениями (внутренние комплексные соли),
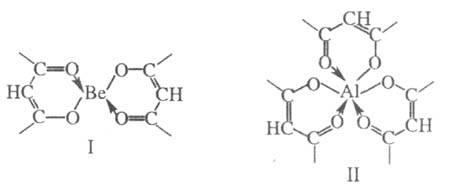
напр, ацетилацетонаты ф-л I и II. Бидентатные лиганды занимают
во внутр. сфере X. два координац. места, как, напр., в соед. I и II. Примеры
др. бидентатных лигандов: этиленгликоль (ф-ла III; два центра типа A)1
диоксид метилендифосфина (IV; два центра типа Б), a-пиколиновая к-та
(IV; центры типа А и Б). Тридентатный лиганд, напр.
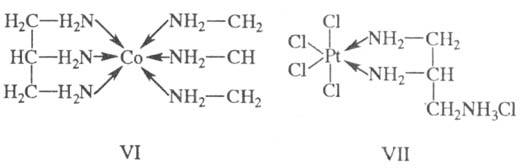
триаминопропан, может занимать во внутр. сфере как три (соед. VI), так и два
(соед. VII) координационных места или даже координироваться моно-дентатно. Аналогично тетра-, пента-
.и гексадентатные лиганды в зависимости от условий проявляют разную дентатность.
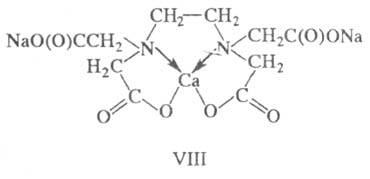
Напр., гексадентатный лиганд ЭДТА (этилендиаминтетраук-сусная к-та) по отношению
к иону Ca2+ является тетрадентатным,
при этом м. б. выделена динатриевая соль VIII. К X. с полидентатными лигандами
относятся комплексы краун-эфи-ров и криптандов
. Стабильность X. обычно
выше по сравнению с аналогами, образованными монодентатными лигандами (т. наз.
хелатный эффект).
В общем виде константа образования циклич. комплекса MAA (M - металл; AA - бидентатный
лиганд) намного больше, чем константа образования MA2 (A - монодентатный
лиганд, близкий по характеру к лиганду AA). Хелатный эффект оценивают по разности
между логарифмами констант устойчивости MAA и MA2. Наряду с общими факторами,
определяющими устойчивость координац. соед., такими, как природа центр. иона
и координированных донорных атомов лиганда, в случае X. важную роль играют число
атомов в образующемся цикле и наличие кратных связей в мостике между донорными
атомами хелатного лиганда. X. чаще всего имеют тетраэдрич.
и октаэдрич. конфигурации; в случае отсутствия кратных связей в мостике наиб,
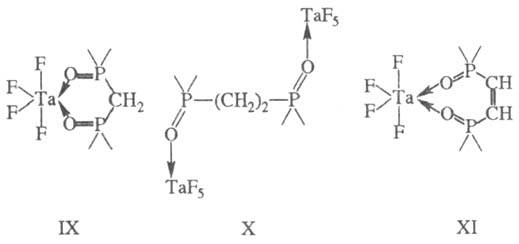
устойчивы 5- и 6-членные циклы (правило циклов Чугаева). Диоксид метил ендифосфина
образует устойчивый 6-членный цикл ф-лы IX. С увеличением длины углеводородного
мостика при переходе к диоксиду этилендифосфи-на последний выступает в роли
мостиковой группы (ф-ла X) и хелатный цикл не образуется. Наличие кратной связи
в диоксиде цис
-винилендифосфина приводит к устойчивости семичленного
цикла XI. 4-членные циклы при тетраэдрич.
и октаэдрич. координации центр, иона являются более напряженными и менее прочными.
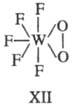
3-членные хелатные циклы известны для перок-сид-аниона, когда последний занимает
два координационных места в экваториальной плоскости пентагональной бипирамиды
(ф-ла ХП).
Выделение X. в самостоятельный
тип координац. соед. связано с уникальностью их физ., хим. и биол. св-в, обусловленных
наличием хелатного цикла. Ацетилацетонаты вследствие их летучести применяют
для разделения и очистки металлов и нанесения металлич. покрытий (см. b
-Дикетонаты металлов). Комплексы ЭДТА из-за их высокой р-римости используют для уменьшения
жесткости воды, снятия накипи и очистки металлич. пов-стей. Яркость цвета, термостойкость,
прочность окраски и устойчивость к действию оснований и к-т обусловливают использование
фталоцианиновых комплексов в качестве красителей. Цветность ряда X. и зависимость
интенсивности окраски р-ра от концентрации иона металла нашли применение в аналит.
химии (см. Комплексо-нометрия, Комплексоны
). Р-римость X. в орг.
р-рителях используют для экстракционного разделения элементов. X. играют важную роль в
процессах жизнедеятельности, напр., гемоглобин, хлорофилл и витамин B12
являются хелатными
комплексами Fe2+-, Mg2+-, Со2+-оснований порфирино-вого
ряда. X. (напр., соед. VI) используют для вывода ядовитых и радиоактивных металлов
из организма и растворения камней (напр., почечных), возникающих при нарушении
обмена веществ. Термин "хелат"
ввел M. Дрю в 1920. Лит.: Гринберг А.А.,
Введение в химию комплексных соединений, 3 изд., M., 1966; БасолоФ., Джонсон
Р., Химия координационных соединений, пер. с англ., M., 1966; Басоло Ф., Пирсон
Р., Механизмы неорганических реакций, пер. с англ., M., 1971; Кукушкин Ю.H.,
Химия координационных соединений, M., 1985. E. Г. Ильин. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ХЕЛАТООБРАЗУЮЩИЕ ИОНООБМЕННЫЕ СМОЛЫ,
будет выглядеть так: Что такое ХЕЛАТООБРАЗУЮЩИЕ ИОНООБМЕННЫЕ СМОЛЫ,