Химическая энциклопедия
"ГАЛОГЕНФТОРИДЫ "
Главная - Химическая энциклопедия - буква Г - ГАЛОГЕНФТОРИДЫ 
ГАЛОГЕНФТОРИДЫ
(фториды галогенов), межгалогенные соед. общей ф-лы ХРn,
где п чаще всего 1, 3 и 5. Известны также неустойчивые IF7,
C12F2 и BrF6. При комнатной т-ре BrF,
IF, IF3 также неустойчивы. В жидкой фазе Г. в результате частичной
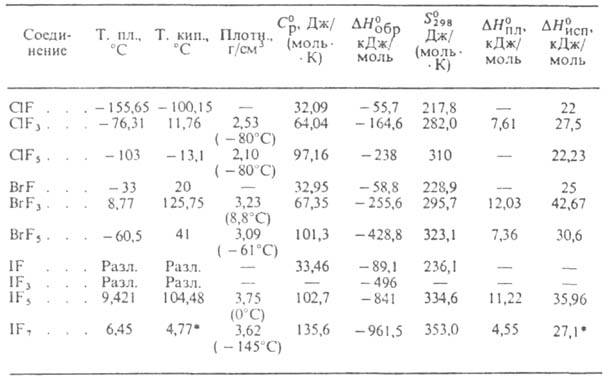
самоионизации (2XFn Г.-фторирующие агенты в орг. синтезе, при переработке соед. U и Ри; реагенты для резки металлов под водой и под землей, в аналит. химии при количеств. определении О2, для травления пов-сти полупроводниковых материалов; перспективные окислители ракетного топлива. Г. токсичны; раздражают слизистые оболочки, в жидком виде вызывают на коже болезненные ожоги и омертвение тканей. Ниже приведены св-ва важнейших Г. (см. также табл.). СВОЙСТВА ГАЛОГЕНФТОРИДОВ
* Т-ра возгонки. Монофторид
хлора ClF-бесцв. газ. Ур-ние температурной зависимости давления пара: lg
р (Па) = 17,863—3109/Т+ 1,538*105/Т2 (123 Трифторид
хлора C1F3-бесцв. газ; кристаллизуется в двух модификациях;
высокотемпературная имеет ромбич. решетку (при -80°С а = 0,882 нм,
Ъ = 0,609 нм, с = = 0,452 нм, пространств. группа Рпта); Пентафторид
хлора С1Р5-бесцв. жидкость; кристаллизуется в трех модификациях.
При нагр. разлагается до C1F3 и F2. Для жидкости
ур-ние температурной зависимости плотности d = 2,696 -3,08*10 -3T
г/мл (193 Трифторид брома BrF3-желтоватая жидкость; кристаллизуется в ромбич. сингонии (при — 125°С а — = 0,534 нм, b = 0,735 нм, с = 0,661нм, z = 4, пространств. группа Стс2). Образует с Вr2 две эвтектики и азеотропную смесь. С O2F2 дает O2BrF5. Получают из элементов при т-ре ок. 20 °С. Пентафторид
брома BrF5 - бесцв. жидкость; кристаллизуется в ромбич. сингонии
(при — 120°С а — = 0,6422 нм, b = 0,7245 нм, с = 0,7846
нм, z = 4, пространств. группа Cmc21). Для жидкости ур-ние температурной
зависимости плотности d = 2,5509-3,484*10-3 t - 3,45*10-6t2
г/мл (- 14,99 Пентафторид
иода IF5-бесцв. жидкость; кристаллизуется в моноклинной сингонии
(при 0°С а= 1,516 нм, b = 0,686 нм, с = 0,182 нм, Гептафторид иода IF7-бесцв. газ; кристаллизуется в двух модификациях; выше — 125°С устойчива кубическая (при — 145°С а = 0,628нм, z = 2, пространств. группа Im3m). При нагр. до 200 °С медленно диссоциирует на F2 и низшие фториды иода. Ур-ние температурной зависимости давления пара над твердым 1gр(Па) = = 9,6216-1291,58/7; над жидким lg р (Па) = 9,485- 1243,9/Т Получают взаимод. иодидов металлов с F2 при 150-300 °С. Лит.:
Химия галоидных соединений фтора, М., 1968; Буслаев Ю. А., Суховерхов
В. Ф., Клименко Н. М., Координационная химия, 1983, т. 9, с. 1011-1031;
Comprehensive inorganic chemistry, v. 2., Oxf.-[a.o.], 1973.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ГАЛОГЕНФТОРИДЫ
будет выглядеть так: Что такое ГАЛОГЕНФТОРИДЫ
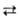 XF
+n-1 + XF-n+1) обладают
небольшой электрич. проводимостью. Наименее электропроводен C1F5
(
XF
+n-1 + XF-n+1) обладают
небольшой электрич. проводимостью. Наименее электропроводен C1F5
(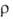 2,2*109 Ом*см), наиболее-ВrF3 (
2,2*109 Ом*см), наиболее-ВrF3 (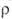 1,3*102 Ом*см). Молекулы C1F3 и BrF3 имеют
Т-образную конфигурацию, в газовой фазе частично димеризованы. Конфигурация
молекул пентафторидов - тетрагон, пирамида. По хим. св-вам Г. близки к
F2, при низких т-рах более реакционноспособны. Гидролизуются
водой и ее парами, часто со вспышкой. Со мн. металлами образуют галогениды,
разлагают большинство орг. соед., пробку, резину. Могут быть донорами или
акцепторами иона F-. С металлами в степени окисления + 1 образуют
соли, содержащие анионы XF2- (если Х-С1 или Вr),
XF6- (Вr или I) и XF-. С к-тами Льюиса
(напр., BF3, AsFJ дают соли с катионами XF2+
(если X—С1 или Вr), XF4+, C12F +
, IF6+, C1F6 + и BrF6+.
1,3*102 Ом*см). Молекулы C1F3 и BrF3 имеют
Т-образную конфигурацию, в газовой фазе частично димеризованы. Конфигурация
молекул пентафторидов - тетрагон, пирамида. По хим. св-вам Г. близки к
F2, при низких т-рах более реакционноспособны. Гидролизуются
водой и ее парами, часто со вспышкой. Со мн. металлами образуют галогениды,
разлагают большинство орг. соед., пробку, резину. Могут быть донорами или
акцепторами иона F-. С металлами в степени окисления + 1 образуют
соли, содержащие анионы XF2- (если Х-С1 или Вr),
XF6- (Вr или I) и XF-. С к-тами Льюиса
(напр., BF3, AsFJ дают соли с катионами XF2+
(если X—С1 или Вr), XF4+, C12F +
, IF6+, C1F6 + и BrF6+.
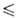 Т
Т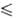 168
К). Получают из элементов или из C1F3 и С12 при 220-250
°С
168
К). Получают из элементов или из C1F3 и С12 при 220-250
°С
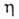 0,0435 Па*с (20,0 °С). Ур-ние температурной зависимости плотности жидкого
d = 1,8853 - 2,492*10-3 t - 3,79*10-6t2 г/мл
( - 5
0,0435 Па*с (20,0 °С). Ур-ние температурной зависимости плотности жидкого
d = 1,8853 - 2,492*10-3 t - 3,79*10-6t2 г/мл
( - 5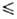 t
t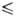 - 46 °С), давления пара lg р(Па) = 9,49201 - 1096,917/(t-232,75) (
- 46,97
- 46 °С), давления пара lg р(Па) = 9,49201 - 1096,917/(t-232,75) (
- 46,97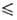 t
t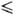 29,55
°С). Растворяет мн. фториды металлов. Получают из элементов при 200-300
°С в присут. катализатора.
29,55
°С). Растворяет мн. фториды металлов. Получают из элементов при 200-300
°С в присут. катализатора.
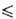 Т
Т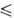 250 К), давления пара lg р (Па) = 9,6086 - 1197/Т (192,95
250 К), давления пара lg р (Па) = 9,6086 - 1197/Т (192,95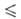 Т
Т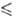 391,05
К). Получают из элементов при 350 °С и давл. 25 МПа (в условиях фотохим.
активирования р-ции - при 0,1 МПа), фторированием MC1F4 (М-щелочной
металл) или электролитич. окислением C1F3 в жидком HF.
391,05
К). Получают из элементов при 350 °С и давл. 25 МПа (в условиях фотохим.
активирования р-ции - при 0,1 МПа), фторированием MC1F4 (М-щелочной
металл) или электролитич. окислением C1F3 в жидком HF.
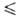 t
t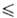 76,44°С),
вязкости
76,44°С),
вязкости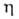 =
1,1*10-4 exp (1197/Т) сП (293,4
=
1,1*10-4 exp (1197/Т) сП (293,4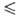 Т
Т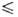 302,0
К), давления пара Igp(Ha) = 10,0976 -- 1598,2/Т (297
302,0
К), давления пара Igp(Ha) = 10,0976 -- 1598,2/Т (297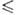 Т
Т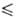 314
К). Получают взаимод. элементов или BrF3 с F2 при
150-300 °С, р-цией КВr с F2 при комнатной т-ре.
314
К). Получают взаимод. элементов или BrF3 с F2 при
150-300 °С, р-цией КВr с F2 при комнатной т-ре.
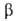 93,23°,
z = 20, пространств. группа С2с). Ур-ние температурной зависимости вязкости
93,23°,
z = 20, пространств. группа С2с). Ур-ние температурной зависимости вязкости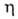 = 0,004325/(1 -0,04231t + 0,000014t2) Па*с (14,55
= 0,004325/(1 -0,04231t + 0,000014t2) Па*с (14,55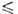 t
t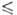 69,30°С), давления пара Igp(Пa) = 10,7838 - 2159/Т (Т
69,30°С), давления пара Igp(Пa) = 10,7838 - 2159/Т (Т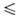 282,57 К), Igp(Пa) = 31,14657 - 30,9014/Т- 6,968 lg Т (293
282,57 К), Igp(Пa) = 31,14657 - 30,9014/Т- 6,968 lg Т (293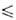 Т
Т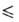 378
К). Получают взаимод. I2, I2О5 или иодидов
металлов с F2, C1F3 и др. фторирующими агентами при
комнатной т-ре или небольшом нагревании.
378
К). Получают взаимод. I2, I2О5 или иодидов
металлов с F2, C1F3 и др. фторирующими агентами при
комнатной т-ре или небольшом нагревании.