ЭТИЛОВЫЙ СПИРТ
(этанол, метилкарбинол,
винный спирт) C2H5OH, мол. м. 46,069; бесцв. легкоподвижная
жидкость с характерным запахом и жгучим вкусом; т. пл. -114,15 °С, т. кип.
78,39 °С; 0,78927;
0,78927; 1,3611; tкрит 243,1 °С, ркрит 6,395
МПа, dкрит 0,275 г/см3;
1,3611; tкрит 243,1 °С, ркрит 6,395
МПа, dкрит 0,275 г/см3; 1,17 мПа х с (20 °С);
1,17 мПа х с (20 °С); 231 мН/м (25 °С);
231 мН/м (25 °С); 5,67 х 10-30 Кл х м (в бензоле); Ср (20 °С)
2,428 кДж/(кг х К) (для жидкости), 1,197 кДж/(кг х К) (для пара);
5,67 х 10-30 Кл х м (в бензоле); Ср (20 °С)
2,428 кДж/(кг х К) (для жидкости), 1,197 кДж/(кг х К) (для пара); 839,3 Дж/г;
839,3 Дж/г; 4,81 кДж/моль;
4,81 кДж/моль; -29,68 кДж/г;
-29,68 кДж/г;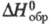 -234,8 кДж/моль (для пара);
-234,8 кДж/моль (для пара); 281,380 Дж/(моль-К),
281,380 Дж/(моль-К), 25,7 (20 °С).
25,7 (20 °С).
Э. с. смешивается во всех соотношениях
с водой (св-ва водных р-ров Э. с. приведены в табл.), спиртами, диэтиловым
эфиром, глицерином, хлороформом, ацетальдегидом, бензином и др.; образует
азеотропные смеси с водой (95,6% по массе Э. с., т. кип. 78,15 оС);
бензолом (32,4%, 68,24 °С); гексаном (21%, 58,7 °С); толуолом (68%, 75,65
°С); этилацетатом (30,8%, 71,8 °С) и др., а также тройные азеотропные смеси,
напр. Э. с.- бензол - вода (содержание в % по массе соотв. 18,5-74,1-7,4,
т. кип. 64,86 °С), Э. с.-дихлорэтан -вода (17-78-5, 66,7 °С). Э. с. горит
бледно-голубым пламенем.
Химические свойства. Э. с.- типичный
одноатомный алифатич. спирт
. С металлами образует этилаты, напр.
C2H5ONa, (С2Н5О)3А1;
с неорг. и орг. к-тами, ангидридами, галогенангидридами - сложные эфиры,
напр. с Н2SO4 этилсульфат С2Н5ОSО3Н
или диэтилсульфат (С2Н5О)2SO2,
с СН3СООН -этилацетат. Р-ция с эпоксидами приводит к раскрытию
кольца и образованию гидроксиэфиров, напр.:

СВОЙСТВА ВОДНЫХ РАСТВОРОВ ЭТИЛОВОГО
СПИРТА
|
Содержание этилового
спирта в фазе, молярные %
|
Т. кил., оС
|
|
|
|
жидкость
|
пар
|
|
|
10
|
43,7
|
86,2
|
0,96571
|
|
|
20
|
52,8
|
82,9
|
0,93697
|
|
|
30
|
57,25
|
81,64
|
0,89848
|
|
|
40
|
61,02
|
80,66
|
0,88396
|
|
|
50
|
64,75
|
79,96
|
0,86308
|
|
|
60
|
69,8
|
79,4
|
0,84509
|
|
|
70
|
75,3
|
78,89
|
0,82296
|
|
|
80
|
81,55
|
78,47
|
0,81499
|
|
|
90
|
89,9
|
78,2
|
0,80178
|
|
|
100
|
100
|
78,39
|
0,78927
|
|
Дегидратация Э. с. приводит к этилену или
диэтиловому эфиру; дегидрирование - к ацетальдегиду; р-ция с альдегидами
и кетонами RRCO - к ацеталям RRC(OC2H5)2;
с NaClO -к хлороформу (см. Галоформная реакция
), хлорирование -
к хлоралю; взаимод. с NH3 - к моно-, ди- и триэтиламинам; р-ция
с РОС13 или SO2C12 в присут. третичных
аминов - к полным эфирам фосфорной или серной к-ты. При пропускании паров
Э. с. над сложным катализатором при 380-400 °С образуется 1,3-бутадиен,
при взаимод. Э. с. с ацетиленом -винилэтиловый эфир С2Н5ОСН
= СН2.
Получение. В пром-сти Э. с. получают
анаэробным брожением углеводов растит. происхождения в присут. дрожжей
и гидратацией этилена. Перспективен способ получения Э. с. из синтез-газа:
прямым синтезом из СО и Н2 либо через метиловый спирт.
Сырьем для произ-ва Э. с. служат пищевое
растит. сырье, отходы деревообрабатывающей пром-сти, сульфитные щелоки.
Сбраживание пищевого растит. сырья- наиб.
древний способ получения Э. с., известный с доисторич. времен. Перед брожением
сырье (сок плодово-ягодных культур, зерно, картофель, меласса - отход сахароварения)
очищают, толстокожурное зерно дробят и разваривают 1-2 ч острым паром при
давлении 0,4-0,5 МПа для разрушения клеточных оболочек. Крахмалсодержащее
сырье перед подачей на брожение осахаривают ферментсодержащим препаратом
(солодом или микробными ферментами) при 60 °С. При необходимости сырье
подкисляют, добавляют водный р-р аммиака и фосфаты. Брожение происходит
в присут. дрожжей при 15-30 °С, длительность от 10-15 ч до 2-3 сут. Теоретич.
выход Э. с. определяется ур-нием р-ции: С6Н12О6 2С2Н5ОН + 2СО2; практич. выход 90-93%.
Побочно при брожении образуются метанол, спирты С3-С5,
глицерин, янтарная к-та, ацетальдегид, сложные эфиры и др. Реакц. смесь
после брожения (бражку) очищают на ректификационных установках; остаток
от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение
1 т Э. с.: картофеля 10-13 т, ячменя 4-5 т, пшеницы и кукурузы 3,5-4 т.
О механизме спиртового брожения см. в ст. Брожение
.
2С2Н5ОН + 2СО2; практич. выход 90-93%.
Побочно при брожении образуются метанол, спирты С3-С5,
глицерин, янтарная к-та, ацетальдегид, сложные эфиры и др. Реакц. смесь
после брожения (бражку) очищают на ректификационных установках; остаток
от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение
1 т Э. с.: картофеля 10-13 т, ячменя 4-5 т, пшеницы и кукурузы 3,5-4 т.
О механизме спиртового брожения см. в ст. Брожение
.
Гидролиз отходов деревообрабатывающей
пром-сти осуществляют водой в присут. к-т либо солей, дающих кислую р-цию
(см. Гидролизные производства
). Сбраживание полученных Сахаров и
выделение Э. с. из бражки аналогичны вышеописанному. Из 1 т сухой хвойной
древесины получают 130-160 кг Э. с. и до 120 кг сжиженной углекислоты.
При комплексной переработке гидролизата получают также фурфурол, кормовые
дрожжи, гипс, лигнин. Метод используют в основном в России. За рубежом
применяют ограниченно из-за высокой себестоимости спирта.
Для получения Э. с. из сульфитных щелоков
(отход произ-ва целлюлозы методом сульфитной варки древесины) древесину
обрабатывают р-ром, содержащим 3-6% своб. SO2 и 2% SO2
в виде гидросульфитов щелочных или щел.-зем. металлов при 135 150 °С и
повыш. давлении. При этом целлюлоза не растворяется, а в р-р сульфитных
щелоков переходят сульфолигнин, олиго- и моносахариды, часть смол, формальдегид
и др. Щелоки продувают паром или воздухом, нейтрализуют известковым молоком,
отделяют от гипсового шлама и направляют на сбраживание. Выход Э. с. на
1 т переработанной древесины ок. 80 кг; побочно образуется до 60 кг белковых
дрожжей и 600-700 г сульфолигнина.
Осн. пром. способ получения синтетич.
Э. с.- прямая гидратация этилена; катализатор - ортофосфорная к-та на пористом
носителе (силикагель, диатомит, кизельгур, пористые стекла и др.). В качестве
побочных продуктов образуются: ацетальдегид, диэтиловый эфир, кретоновый
альдегид, ацетон, спирты С3-С4, метилэтилкетон, низкомол.
полиэтилен.
Технол. схема произ-ва Э. с.: смесь этиленсодержащего
газа и воды нагревают в системе теплообменников (в осн. за счет тепла,
выходящего из реактора потока, а на последней ступени - печи огневого нагрева
или паром высокого давления в теплообменнике) и подают в реактор - цилиндрич.
аппарат, заполненный катализатором (для защиты от коррозии реактор футеруется
медью). На выходе из реактора или после охлаждения потока до точки росы
реакц. смесь нейтрализуют р-ром щелочи. Поток охлаждают направляемым в
реактор сырьем, на последней ступени - в водяном холодильнике. Э. с., непрореагировавшая
вода и побочные продукты р-ции конденсируются, водно-спиртовый р-р (содержание
Э. с. ок. 13%) сепарируется от непрореагировавшего этилена и направляется
на узел выделения и очистки. Этиленсодержащий газ отмывается от остатков
спирта водой, смешивается со свежими порциями этилена и вновь направляется
в реактор.
Очистка Э. с. включает все или нек-рые
из след. стадий: удаление из водно-спиртового р-ра легкокипящих головных
фракций (ацетальдегид, диэтиловый эфир, ацетон, кротоновый альдегид, легкие
полимеры) экстрактивной дистилляцией с водой; ректификацию кубового продукта
и получение спирта-сырца (90-94% Э, с.); гидрирование спирта-сырца при
100 °С в паровой (давление 0,1-0,2 МПа), чаще жидкой фазе (давление 1,5-2,5
МПа) на никельсодержащем катализаторе; окончат. ректификацию (95-96%-ный
Э. с.). Спирт, очищенный по полной схеме, по качеству не уступает пищевому.
Отходы произ-ва - высшие спирты (применяются
как р-рители), диэтиловый эфир (рециклизуется на стадию гидратации либо
используется как товарный продукт) и полимеры этилена (сжигаются).
Метод получения синтетич. Э. с. сернокислотной
гидратацией этилена, распространенный в 40-60-х гг. 20 в., полностью вытеснен
прямой гидратацией этилена; это связано со сложностью защиты оборудования
от коррозии, высоким расходом H2SO4 и большими энергозатратами,
проблемами экологии.
Произ-во Э. с. и выбор метода определяются
наличием сырьевой базы и соотношением цен на пищевые и нефтепродукты.
Абсолютирование Э. с. осуществляют перегонкой
с третьим компонентом, образующим с Э. с. и водой азеотроп, напр. с бензолом
или циклогексаном. Установка для абсолютирования состоит из 2 колонн. В
первую ректификац. колонну в середину подается 92-95%-ный Э. с., а в верхнюю
часть - бензол. С верха колонны отбирается смесь Э. с., бензола и воды,
из куба - абсолютир. Э. с. (концентрация 99,9%). Смесь конденсируется,
охлаждается и направляется в разделит. сосуд для расслаивания. Бензол возвращается
в колонну абсолютирования, а водно-спиртовый р-р - на вторую ректификац.
колонну, в к-рой выделяют 92-95%-ный Э. с., рециклизуемый в первую колонну.
Разработаны способы пром. абсолютирования
Э. с. на мол. ситах, полупроницаемых мембранах, абсорбцией жидким СО2,
сжиженными алкенами и др. Иногда абсолютирование ведут азеотропной перегонкой
с бензиновыми фракциями, особенно в случаях, когда абсолютир. Э. с. используется
как добавка к моторному топливу. В препаративных целях Э. с. абсолютируют
СаС12, CuSO4, мол. ситами и др.
Идентифицируют Э. с. физ.-хим. методами
либо через фенилуретан, т. пл. 57 °С.
Применение. Э. с. - р-ритель в лакокрасочной
и фармацев-тич. пром-сти, в произ-ве кинофотоматериалов, товаров радиоэлектроники
и бытовой химии, ВВ и др. Сырье в произ-ве диэтилового эфира, хлороформа,
тетраэтилсвинца, ацетальдегида, уксусной к-ты, этилацетата, этиламина,
этилакрилатов, этилсиликатов и др. Э. с. из пищ. сырья часто используют
для получения чистого этилена. Э. с.- компонент антифриза, топливо для
реактивных двигателей. В ряде стран - компонент автомобильного топлива:
повышает октановое число, сокращает расход бензина, снижает содержание
вредных в-в в выхлопных газах. Содержание Э. с. в автомобильном топливе
в зависимости от сырьевой базы составляет от 10% в США до полной замены
бензина этанолом в Бразилии.
Для техн. целей часто используют денатурированный
спирт (денатурат) - спирт-сырец, содержащий добавки красителя, окрашивающего
Э. с. в сине-фиолетовый цвет, и спец. в-в, придающих ему неприятный запах
и вкус; денатурат ядовит. В медицине Э. с. применяется для дезинфекции,
как поверхностное сосудорасширяющее ср-во, коагулянт белка, в т. ч. при
лечении ожогов. Значит. часть Э. с. идет на изготовление спиртных напитков.
Э. с. чрезвычайно гигроскопичен, при концентрации
выше 70% (по объему) прижигает кожу и слизистые оболочки; при приеме внутрь
угнетает центры торможения мозга, вызывает опьянение, при многократном
употреблении - алкоголизм.
Легко воспламеняется, т. всп. 13 °С, т.
самовоспл. 404 °С, пределы взрываемости: температурные 11-41 °С, концентрационные
3,6-19% (по объему), ПДК в атм. воздухе 5 мг/м3, в воздухе рабочей
зоны 1000 мг/м3, ЛД50 9 г/кг (крысы, перорально).
Наиб. крупные производители Э. с. (тыс.
т в год): Бразилия 7500 (1985), США 2700 (1986), Россия 1200 (1989), Великобритания
200 (1986), Япония 179 (1985).
Впервые Э. с. выделен из продуктов брожения
в Италии в 11-12 вв. Абсолютир. Э. с. получил перегонкой водного р-ра над
поташом Т. Е. Ловиц (1796). В 1855 М. Бертло синтезировал Э. с. из этилена
через этил серную к-ту. Произ-во синтетич. Э. с. началось с 1930 в США.
Лит.: Брунштейн Б. А., Клименко
В. Л., Цыркин Е.Б., Производство спиртов из нефтяного и газового сырья,
Л., 1964; Сапотницкий С. А., Использование сульфитных щелоков, 2 изд.,
М., 1965; Технология гидролизных производств, М., 1973; Стабников В. Н.,
Ройтер И. М., Процюк Т. Б., Этиловый спирт, М., 1976; Новые тенденции в
производстве синтетического этилового спирта, М., 1981; Справочник по производству
спирта. Сырье, технология и технохимконтроль, М., 1981.
Б. С. Боуден.
|

 0,78927;
0,78927; 1,3611; tкрит 243,1 °С, ркрит 6,395
МПа, dкрит 0,275 г/см3;
1,3611; tкрит 243,1 °С, ркрит 6,395
МПа, dкрит 0,275 г/см3; 1,17 мПа х с (20 °С);
1,17 мПа х с (20 °С); 231 мН/м (25 °С);
231 мН/м (25 °С); 5,67 х 10-30 Кл х м (в бензоле); Ср (20 °С)
2,428 кДж/(кг х К) (для жидкости), 1,197 кДж/(кг х К) (для пара);
5,67 х 10-30 Кл х м (в бензоле); Ср (20 °С)
2,428 кДж/(кг х К) (для жидкости), 1,197 кДж/(кг х К) (для пара); 839,3 Дж/г;
839,3 Дж/г; 4,81 кДж/моль;
4,81 кДж/моль; -29,68 кДж/г;
-29,68 кДж/г;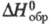 -234,8 кДж/моль (для пара);
-234,8 кДж/моль (для пара); 281,380 Дж/(моль-К),
281,380 Дж/(моль-К), 25,7 (20 °С).
25,7 (20 °С).


 2С2Н5ОН + 2СО2; практич. выход 90-93%.
Побочно при брожении образуются метанол, спирты С3-С5,
глицерин, янтарная к-та, ацетальдегид, сложные эфиры и др. Реакц. смесь
после брожения (бражку) очищают на ректификационных установках; остаток
от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение
1 т Э. с.: картофеля 10-13 т, ячменя 4-5 т, пшеницы и кукурузы 3,5-4 т.
О механизме спиртового брожения см. в ст.
2С2Н5ОН + 2СО2; практич. выход 90-93%.
Побочно при брожении образуются метанол, спирты С3-С5,
глицерин, янтарная к-та, ацетальдегид, сложные эфиры и др. Реакц. смесь
после брожения (бражку) очищают на ректификационных установках; остаток
от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение
1 т Э. с.: картофеля 10-13 т, ячменя 4-5 т, пшеницы и кукурузы 3,5-4 т.
О механизме спиртового брожения см. в ст.