Химическая энциклопедия
"ФТАЛОЦИАНИНЫ"
Главная - Химическая энциклопедия - буква Ф - ФТАЛОЦИАНИНЫ
ФТАЛОЦИАНИНЫ
, макрогетероциклич.
соединения, содержащие цикл тетраазатетрабензопорфина; структурно родственны
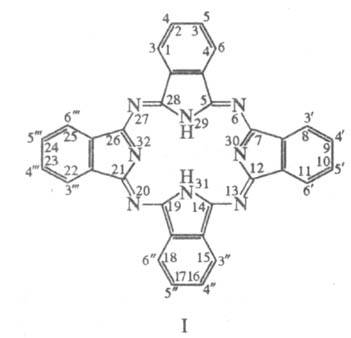
порфиринам. Родоначальник ряда - собственно фталоцианин (ф-ла I). Атомы
в цикле нумеруют согласно номенклатуре ИЮПАК (цифры указаны внутри кольца) или
рациональной номенклатуре, учитывающей гене-тич. связь с производными соответствующих
фталевых к-т (цифры снаружи кольца). В практически плоском цикле Ф. 4 атома
N - 6, 13, 20 и 27, связывающие фрагменты изо-индола, наз. мезо
-атомами.
Число изомеров положения для Ф. определяется кол-вом и расположением заместителей
в цикле, напр. Ф. с 4 одинаковыми заместителями (по 1 в каждом бензольном кольце)
могут существовать в виде 4 изомеров. Ф. образуют комплексы (П)
почти со всеми металлами периодич. системы. При этом гетероцикл является экваториальным
лигандом, а другие связанные с атомом металла лиганды располагаются перпендикулярно
плоскости цикла (занимают транс-аксиальные положения). Sn, Ce, Hf, Zr и нек-рые
др. металлы способны также к образованию комплексов типа PcMX2, где
Pc - Ф., X = Hal, OAc и др., и двухъядерных сэндвичевых комплексов типа Pc2MIV.
Прочность связи M-X зависит от природы металла, в частности от величины его
ионного радиуса. Среди комплексов интересны также дифталоцианины с РЗЭ, содержащие
в макрокольце неспаренный электрон и являющиеся стабильными своб. радикалами.
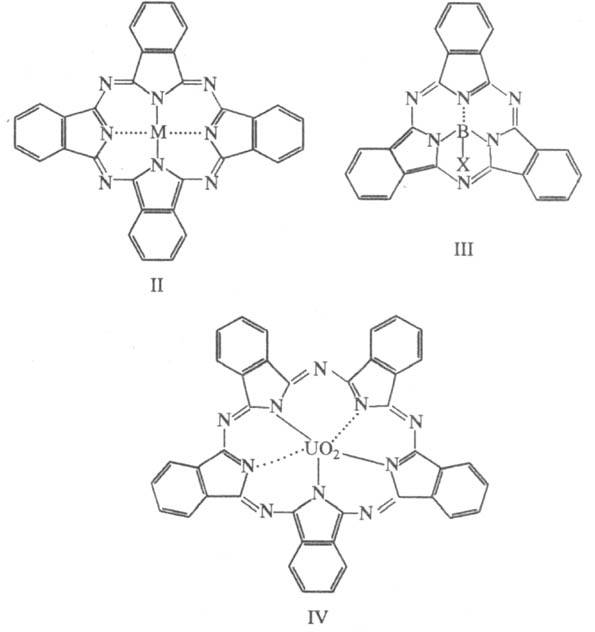
Ионы B3+ способны к образованию триден-татного аналога фгалоцианинового
комплекса с осью симметрии 3-го порядка (Ш), a UO+2 -
пентадентатного аналога с осью 5-го порядка (IV). Ф.- порошки или кристаллы
разл. оттенков синего или голубого цвета. При нагр. в вакууме до 350-400 0C
возгоняются. Раств. в конц. H2SO4, трудно раств. при нагр.
в высококипящих орг. р-рителях (хлорнафталин, хинолин, трихлор-бензол, нитробензол
и т. п.), не раств. в воде. Наличие в бензольных кольцах Ф. объемистых заместителей,
напр. mpem-бугилъных, триметилсилильных, мезитильных, неопен-тилоксильных, существенно
повышает р-римость Ф. в орг. р-рителях, что облегчает изучение их св-в в р-рах. Электронные спектры поглощения
Ф. в 1-хлорнафталине, Введение в бензольные кольца
электронодонорных заместителей приводит к батохромному смещению длинноволновой
полосы на ~ 100 нм. У симметричных линейно-аннели-рованных нафталиновых аналогов
Ф. Ф. обладают св-вами ароматических соединений
. Вступают в нек-рые р-ции электроф. замещения - галогенирование,
сульфирование, хлорметилирование, нитрование. Хлорирование Ф. меди в жестких
условиях, напр, в расплаве AlCl3 и NaCl или в смеси SOCl2
и AlCl3 (180 0C, 20 ч),- пром. способ получения пигмента
зеленого фталоцианинового, содержащего до 15-16 атомов Cl, сульфирование - способ
получения водорастворимых сульфокислот (от моно- до тетрасульфо-производных). Комплексы щелочных и щел.-зем.
металлов, а также Mn, Pb и нек-рых др. металлов в кислой среде легко деме-таллируются;
наиб. устойчивы комплексы Pd, Pt, Os, Ni, Cu и др. Собственно Ф. обладает
амфотерными св-вами. Действие сильных оснований приводит к депротонированию
атомов N с образованием симметричного дианиона, действие сильных к-т - к протонированию
мезо-
атомов N вплоть до тетрапро-тонирования в случае сильных
к-т (конц. H2SO4, хлорсульфо-новая к-та, сверхкислоты
на основе к-т Льюиса). Характерное св-во Ф.- склонность
к окислит.-восстановит. р-циям. При хим. или электрохим. восстановлении Ф. превращаются
сначала в анион-радикал, затем в дианион и полианионы; при хим. или электрохим.
окислении - в катион-радикал, затем дикатион. Сильные окислители [конц. HNO3,
KMnO4, K2Cr2O7, соли Ce(IV)] разрушают
макроколъ-цо Ф. вплоть до образования фталимида. В случае Ф. нек-рых переходных
металлов (Со, Mn и др.) окислит.-восстановит. р-ции могут происходить также
с участием центр. атома металла. Фгалоцианиновые комплексы
рада переходных металлов (напр., Zn, Со, Fe) склонны к присоединению дополнит.
лиган-дов в аксиальные положения с образованием комплексов типа PcMX2,
где X = Hal, CN, пиридил и т.д. С двухатомными основаниями типа пиразина, g-дипиридила
образуют линейные полимеры, отличающиеся металлич. проводимостью. Собственно Ф. чаще всего
получают из фталодинитрила в присут. алкоголятов щелочных металлов в высококипящих
спиртах с послед. деметаллированием образующегося комплекса к-той; др. способы:
обработка фталодинитрила аммиаком в 2-N,N-диметиламиноэтанэле или нагревание
1,3-дииминоизоин-долина в том же р-рителе. Использование в этих р-циях замещенных
o-фталевых к-т и их конденсированных аналогов приводит к замещенным Ф.
Подобная конденсация производных тетракарбоновых к-т (напр., нитрила пиромеллитовой
к-ты), производных дифенил- или бензофенон-3,3,4,4-тетракарбоно-вых к-т -
способ получения разл. олигомерных (полимерных) Ф. и их аналогов сетчатой структуры. Обычный метод получения
Ф. металлов - темплатная тет-рамеризация о-фталодинитрила при его нагр.
с соответствующими металлами или их солями. На практике часто проводят тетрамеризацию
фталевого ангидрида (к-ты, имида) с мочевиной (или др. донорами NH3)
и солями металлов в присут. катализаторов [(NH4)2MoO4,
H3BO3 и др.] в орг. р-рителях или без них (метод запекания). Многие Ф. металлов - фталоцианиновые красители
, полупроводники и фотопроводники в электрофотографии и при создании
солнечных элементов (батарей). Ф. являются также эффективными катализаторами
сероочистки (комплексы с Fe, Со, Mn и др.), окисления орг. соед., нек-рых электрохим.
процессов - восстановления O2 и CO2, окисления SO2
и ряда фотохим. процессов (напр., преобразование солнечной энергии) с помощью
мол. фотокаталитич. систем. Ф. сетчатой структуры - основа термостойких полиэфирных
и полиимид-ных материалов. Водорастворимые производные Ф., спосогз-ные селективно
накапливаться в опухолях, применяют в медицине для фотодиагностики и фототерапии
раковых заболеваний. Лит.: Березин Б.Д.,
Координационные соединения порфиринов и фта-лоцнанннгц M., 1978; Степанов Б.И.,
Введение в химию и технологию органических красителей, 3 изд., M., 1984; Порфирины:
структура, свойства, синтез, M., 1985; Порфирины: спектроскопия, электрохимия,
применение, под ред. Н.С. Ениколопяна, M., 1987; M о s е г F.H., Thomas A.L.,
Phthalocyanine compounds, N.Y., 1963; Moser F.H., Thomas A.L., The phthalocyanines,
v. 1-2, Boca Raton (FIa.), 1983; Phthalocyanines: properties and applications,
ed. by C.C. Leznoff, A.B.P. Lever, N.Y., 1989. C.A. Борисенкова, E.A. Лукьянец. |
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ФТАЛОЦИАНИНЫ
будет выглядеть так: Что такое ФТАЛОЦИАНИНЫ
 нм (lge): для собственно Ф.- 698 (5,21), 665 (5,18), 638 (4,62), 602 (4,43),
350 (4,74); для Ф. меди - 678 (5,34), 648 (4,51), 611 (4,26), 350 (4,76).
нм (lge): для собственно Ф.- 698 (5,21), 665 (5,18), 638 (4,62), 602 (4,43),
350 (4,74); для Ф. меди - 678 (5,34), 648 (4,51), 611 (4,26), 350 (4,76).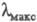 750-855
нм (в зависимости от центрального атома металла).
750-855
нм (в зависимости от центрального атома металла).