Химическая энциклопедия
"ФОСФАТЫ НЕОРГАНИЧЕСКИЕ"
Главная - Химическая энциклопедия - буква Ф - ФОСФАТЫ НЕОРГАНИЧЕСКИЕ
ФОСФАТЫ НЕОРГАНИЧЕСКИЕ
,
соли кислородных к-т фосфора в степени окисления +5 (см. Фосфора кислоты
).
Существуют ортофосфаты - соли ортофосфорной к-ты H3PO4
и фосфаты конденсированные
- соли полифосфорных к-т. Различают средние,
кислые и основные фосфаты, разнокатион-ные (двойные и тройные соли) и разноанионные
(смешанные соли), оксифосфаты, а также разл. неорг. производные (напр., тиофосфаты).
Анионы Ф. н. построены из тетраэдров PO4 с атомами О в вершинах.
Ортофосфаты состоят из изолированных
тетраэдров, в конденсированных Ф. н. тетраэдры связаны в кольца или цепочки
через общие вершины. Кислые Ф. н. образуются
в результате частичной нейтрализации H3PO4 или полифосфорных
к-т основаниями. При полной нейтрализации гидроксидами одного или неск. металлов
получают средние Ф. н.- соотв. одного металла или двойные Ф. н. Смешанные соли
образуются при нейтрализации смеси к-т, напр. ди- и трифосфорных, одним гидроксидом
(ординарные разноанионные Ф. н.) или неск. гидроксидами (разнокатионно-разноанионные
Ф. н.). Нейтрализующим агентом служит и NH3. Конденсированные Ф.
н. получают также термич. обработкой кислых Ф. н., смесей Ф. н. При этом состав
исходного продукта (в пересчете на оксиды) Ортофосфаты встречаются
в природе в виде минералов (известно ок. 190), важнейшие из них - апатит
и фосфориты
(см. также Фосфор
). Средние Ф. н. Общее
св-во безводных солей - стабильность при нагр. до т-ры плавления. Ортофосфаты
МII3(РО4)2 плавятся при 1375 (M
= Mg), 1777 (Ca), 1600 (Sr), 1605 (Ba), 1152 (Mn), 1345 (Ni), 1060 (Zn), 1014
0C (Pb), дифосфаты MII2P2O7
- при 1382 (Mg), 1355 (Ca), 1375 (Sr), 1430 (Ba), 1195 (Mn), 1400 (Ni), 1020
(Zn), 830 0C (Pb). Исключение составляют неустойчивые Ф. н. (с катионами
NH+4, Hg2+), напр. Hg3(PO4)2,
из к-рого часть ртути улетучивается ниже т-ры плавления. В противоположность
ортофосфатам конденсированные Ф. н. Pn при плавлении превращаются
в фосфатные смеси Рт. Кристаллогидраты мн. ортофосфатов
и нек-рых конденсированных Ф. н. при нагр. теряют кристаллизационную воду ступенчато
без изменения состава аниона. На этом св-ве основан топохим. способ синтеза
безводных солей, к-рые не удается получить др. способами. Так, топохим. путем
из (NH4)5P3O10·хH2O,
где х=I, 2, в среде газообразного NH3 получен кристаллич.
(NH4)5P3O10. Средние Ф. н. металлов
в высоких степенях окисления не раств. в воде, щелочных металлов и аммония -
раств., их водные р-ры имеют рН > 7. Анионы конденсированных Ф. н. не стабильны
в водных р-рах, они последовательно превращаются в анионы низших Ф. н. Кислые и основные Ф.
н. Р-римость в воде кислых и основных Ф. н. выше, чем у средних, в р-р переходят
даже нек-рые соли металлов в высоких степенях окисления. Благодаря этому св-ву
кислые Ф. н. используют в качестве удобрений. При рН < 7 сложные анионы быстрее
разлагаются до простых (по сравнению с рН > 7). При нагр. в результате конденсации
кислые соли меняют анионный состав ниже т-ры плавления, благодаря чему они служат
исходными соед. для получения мн. конденсированных Ф. н. Помимо гидро- и дигидроортофосфатов
щелочных металлов известны кристаллич. кислые ортофосфаты: MIIHPO4,
где M = Be, Mg, Ca, Sr, Ba, Mn, Zn, Cd, Sn, Pb, Hg, их кристаллогидраты с одной
молекулой воды (M = Be, Mg, Cu, Zn), двумя (Ca, Со, Ni), тремя (Mg, Mn, Zn)
и семью (Mg); MII(Н2РО4)2, где M
= Mg, Sr, Ba, Cu, Cd, Sn, Pb, их кристаллогидраты с одной молекулой воды (M
= Ca, Sr), двумя (Mg, Mn, Fe, Со, Ni, Zn, Cd) и четырьмя (Mg); содержащие неск.
анионных форм: Со(Н2РО4)2·2H3PO4,
NaH2PO4·Na2HPO4 (используется при
получении триполифосфата Na). Получены дигидродифосфаты MII2H2P2O7,
где M = Ca, Sn, Ba, Mn, Fe, Со, Ni, Zn, Pb; кислые трифосфаты MI3H2P3O10·1,5H2O,
где M = Na, Rb; MII2HP3O10, где
M = Ca, Pb; MIIIH2P3O10, где M =
Al, Cr, Fe, а также их моно-, ди- и тригидраты. Кристаллич. тригидрофосфат
K2H3P3O10·2H2O отличается
от гидро- и дигидрофосфатов способностью менять консистенцию при мех. активации
и превращаться в пластилино-подобную массу. Эффект связан с диспропорционированием,
к-рое в кислых солях разл. металлов проявляется по-разному. При вьщерживании
кристаллов MnHPO4·3H2O во влажной среде в их объеме возникают
и растут жидкие и твердые включения продуктов распада исходной кислой соли на
менее протонированную соль и свободную к-ту: ХАРАКТЕРИСТИКА НЕОРГАНИЧЕСКИХ
ФОСФАТОВ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
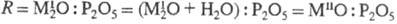 должен отвечать составу синтезируемого соединения (О < R
должен отвечать составу синтезируемого соединения (О < R 3).
В области значений 3 < R
3).
В области значений 3 < R 8
получают оксифосфаты. Характеристики нек-рых Ф. н. приведены в таблице.
8
получают оксифосфаты. Характеристики нек-рых Ф. н. приведены в таблице.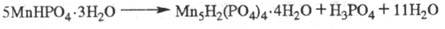
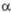 , град
, град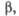 град
град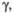 град
град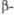 [Cd(PO3)2]n·H2O
[Cd(PO3)2]n·H2O