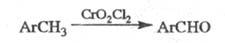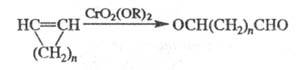Химическая энциклопедия
"ЭТАРА РЕАКЦИЯ"
Главная - Химическая энциклопедия - буква Э - ЭТАРА РЕАКЦИЯ
ЭТАРА РЕАКЦИЯ , окисление метильной группы в ароматич. соед. в альдегидную под действием хромилхлорида (иногда к Э. р. относят любые р-ции в орг. химии с участием СrO2С12):
Ароматич. ядро может содержать заместитель:
Hal, NO2, Alk и АlkO (хотя две последние группы также могут
окисляться в ходе р-ции). Вместо СrО2С12 можно использовать
CrO2(OCOR)2 (R= CH3, С6Н5,
СС13), что способствует увеличению выхода.
Э. р. используют в препаративной практике. Р-ция открыта А. Этаром в 1877. Лит.: Грагеров И.П., Пономарчук М.П., "Ж. орган. химии", 1967, т. 3, № 3, с. 458-64; 1969, т. 5, № 6, с. 1145-47; Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 295-96; Наг ford W., "Chem. Вег.", 1958, Bd 58, S. 25; Nenitzescu C, "Bull. Soc. chim. France", 1968, p. 1349. Г. И. Дрозд.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ЭТАРА РЕАКЦИЯ
будет выглядеть так: Что такое ЭТАРА РЕАКЦИЯ