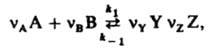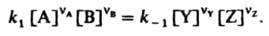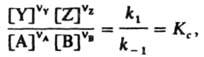ДЕЙСТВУЮЩИХ МАСС ЗАКОН
: при установившемся хим. равновесии между реагентами и продуктами
р-ции выполняется равенство 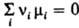 ,
где mi
- хим. потенциал i-го компонента системы, ni
- eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов
р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать
как идеальные газы, mi
выражается через парциальное давление pi: ,
где mi
- хим. потенциал i-го компонента системы, ni
- eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов
р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать
как идеальные газы, mi
выражается через парциальное давление pi:
mi = mi0 (T) + RT ln pi,
где R - газовая постоянная, Т - т-ра, mi0 (T) - не зависящая от давления составляющая mi. С помощью этого соотношения Д. м. з. можно выразить равенством:
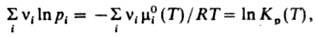
где Кр(Т)- константа равновесия р-ции. Часто левую часть этого равенства записывают в виде произведения: 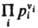 = Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение Д. м. з.: = Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение Д. м. з.: 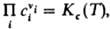 , т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением: , т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением:
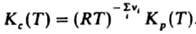
Для реальных газов хим. потенциал выражают через летучести fi компонентов и Д. м. з. записывают в виде:
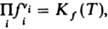 численные значения констант равновесия
Kf(T)и Кр(Т)совпадают.
Для р-ций в разбавл. р-рах Д. м. з. связывает концентрации реагирующих и образующихся в р-ре частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для р-ций в р-рах константа зависит, вообще говоря, не только от т-ры, но и от внеш. давления р. Так, численные значения констант равновесия
Kf(T)и Кр(Т)совпадают.
Для р-ций в разбавл. р-рах Д. м. з. связывает концентрации реагирующих и образующихся в р-ре частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для р-ций в р-рах константа зависит, вообще говоря, не только от т-ры, но и от внеш. давления р. Так, 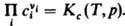 При невысоких давлениях зависимостью К от р обычно пренебрегают.
В общем случае для р-ций в р-рах Д. м. з. выражают через активности аi компонентов: При невысоких давлениях зависимостью К от р обычно пренебрегают.
В общем случае для р-ций в р-рах Д. м. з. выражают через активности аi компонентов: 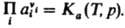 Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением: Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением: 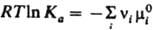 , где mi0 - хим. потенциал i-го в-ва при ai = 1.
В хим. кинетике Д. м. з. выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны.
Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.: , где mi0 - хим. потенциал i-го в-ва при ai = 1.
В хим. кинетике Д. м. з. выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны.
Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.:
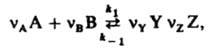
где Y и Z - продукты, nY и nZ - их стехиометрич. коэф., то в условиях равновесия скорости прямой и обратной р-ций равны:
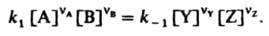
Отсюда следует, что
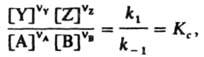
где Кс - константа равновесия р-ции.
Д. м. з. широко используется для расчета равновесных концентраций продуктов р-ции; он позволяет также предсказать направление, в к-ром смещается хим. равновесие при изменении условий протекания р-ции. Для необратимых р-ций Д. м. з. позволяет рассчитать скорость р-ции при любых концентрациях реагентов, если известна константа скорости р-ции.
Д. м. з. был установлен К. Гульдбергом и П. Вааге в 1864-67; его строгий термодинамич. вывод получен
Дж. Гиббсом
в 1875-78. Е.Т. Денисов.
|

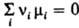 ,
где mi
- хим. потенциал i-го компонента системы, ni
- eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов
р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать
как идеальные газы, mi
выражается через парциальное давление pi:
,
где mi
- хим. потенциал i-го компонента системы, ni
- eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов
р-ции - положительный). Если реагирующие в-ва и продукты р-ции можно рассматривать
как идеальные газы, mi
выражается через парциальное давление pi: 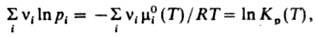
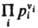 = Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение Д. м. з.:
= Кр(Т). Поскольку для идеальных газов pi = сiRТ, где сi - молярная концентрация i-го в-ва, справедливо след. выражение Д. м. з.: 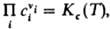 , т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением:
, т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия р-ции Кр(Т)и Кc(Т)связаны соотношением:
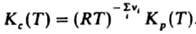
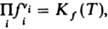 численные значения констант равновесия
Kf(T)и Кр(Т)совпадают.
Для р-ций в разбавл. р-рах Д. м. з. связывает концентрации реагирующих и образующихся в р-ре частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для р-ций в р-рах константа зависит, вообще говоря, не только от т-ры, но и от внеш. давления р. Так,
численные значения констант равновесия
Kf(T)и Кр(Т)совпадают.
Для р-ций в разбавл. р-рах Д. м. з. связывает концентрации реагирующих и образующихся в р-ре частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для р-ций в р-рах константа зависит, вообще говоря, не только от т-ры, но и от внеш. давления р. Так, 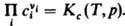 При невысоких давлениях зависимостью К от р обычно пренебрегают.
В общем случае для р-ций в р-рах Д. м. з. выражают через активности аi компонентов:
При невысоких давлениях зависимостью К от р обычно пренебрегают.
В общем случае для р-ций в р-рах Д. м. з. выражают через активности аi компонентов: 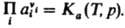 Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением:
Константа равновесия Ка связана со стандартными хим. потенциалами в-в mi0(Т, р) соотношением: 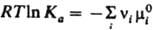 , где mi0 - хим. потенциал i-го в-ва при ai = 1.
В хим. кинетике Д. м. з. выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны.
Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.:
, где mi0 - хим. потенциал i-го в-ва при ai = 1.
В хим. кинетике Д. м. з. выражает скорость v р-ции через концентрации реагентов. Для простой р-ции nAA + nBB : продукты, где А и В - реагирующие в-ва, nA и nВ - их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости р-ции, не зависящая от концентраций реагентов [А] и [В]. Для сложных р-ций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая р-ция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости р-ции и в стехиометрич. ур-нии р-ции часто различны.
Если р-ция протекает обратимо с константами скорости k1 и k_1, напр.: