ЦИНКА ГАЛОГЕНИДЫ
, бесцв. кристаллы
тетрагон. сингонии (табл.; см. также Цинка хлорид
).
Фторид ZnF2
кристаллизуется в структурном типе рутила; при высоких давлениях получены
также моноклинная модификация со структурой типа ZrO2, кубич.
типа флюорита и ромбич. со структурой типа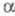 -РbО2;
ур-ние температурной зависимости давления пара lgp (мм рт. ст.)
= 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен,
мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается
горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды
(плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При
гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При
нагр. на воздухе и в токе водяного пара ZnF2 превращается в
ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3
или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2
- материал для лазеров, компонент люминофоров, глазурей, эмалей, спец.
стекол, р-ров для цинкования, консервант для древесины, протрава при крашении.
Токсичен. -РbО2;
ур-ние температурной зависимости давления пара lgp (мм рт. ст.)
= 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен,
мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается
горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды
(плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При
гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При
нагр. на воздухе и в токе водяного пара ZnF2 превращается в
ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3
или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2
- материал для лазеров, компонент люминофоров, глазурей, эмалей, спец.
стекол, р-ров для цинкования, консервант для древесины, протрава при крашении.
Токсичен.
СВОЙСТВА ГАЛОГЕНИДОВ ЦИНКА
|
Показатель
|
ZnF2
|
ZnBr2
|
ZnI2
|
Параметры решетки*,
нм:
а |
|
|
|
|
с
|
0,31335
|
2,180
|
2,354
|
|
Число формульных
единиц в ячейке
|
2
|
32
|
32
|
|
Пространств.
группа
|
Р4/тпт
|
I41/acd
|
I41/acd
|
|
Т. пл., °С
|
890
|
402
|
446
|
|
Т. кип., °С
|
1505
|
670
|
111
|
|
Плотн., г/см3
|
4,94
|
4,20
|
4,736
|
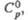
Дж/(моль х К) |
65,6
|
66
|
—
|
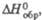
кДж/моль |
-764
|
-329,7
|
-208,2
|
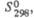
Дж/(моль х К) |
73,7
|
136
|
161
|
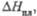
кДж/моль |
41,8
|
15,7
|
17
|
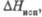
кДж/моль |
185
|
109,6
|
96,2
|
* Тетрагон. сингония.
Бромид ZnBr2 - кроме тетрагон.
модификации, известна ромбоэдрич. со структурой типа CdCl2(a = 0,392 нм, с = 1,873 нм, z = 3, пространств. группа R3m).
Еще
две модификации найдены при высоких давлениях. Может образовывать стекла
с плотн. 3,77 г/см3; летуч, возгоняется; хорошо раств. в воде
(82,5% по массе при 25 °С, 86,6% при 80 °С). При т-рах от -8 до 35 °С из
р-ров кристаллизуется дигидрат ZnBr2 х 2H2O
(т. пл. 37 °С), ниже -8 °С - тригидрат, выше 35 °С - безводный бромид.
Кристаллогидраты, как и безводный бромид, легко расплываются на воздухе.
При гидролизе р-ров бромида образуются гидроксобромиды разл. состава, напр.
Zn5(OH)8Br2. Бромид хорошо раств. в этаноле,
хуже -в эфире, пиридине и хинолине; в CS2 нерастворим. Получают
взаимод. Zn с Вг2 в водном р-ре. Используют как реагент в орг.
синтезе, компонент стекол для ИК оптики, конц. р-ры -для наполнения радиационных
экранов. Слабо токсичен.
Иодид ZnI2 - очень гигроскопичен;
на свету желтеет. Кроме тетрагональной, известны ромбоэдрич. модификация
со структурой типа CdCl2(а = 0,425 нм, с = 2,15
нм) и разл. политипы. При нагр. на воздухе превращается в ZnO. Очень хорошо
раств. в воде (81,2% при 18 °С, 83,1% при 80 °С), этаноле, хуже - в эфире,
ацетоне, глицерине, пиридине; не раств. в CS2. Большим избытком
воды гидролизуется. Устойчивая фаза в водных р-рах ниже 0 °С - дигидрат
(т. пл. 27 °С), выше 0 °С - безводный иодид. Описан также тетрагидрат,
превращающийся при -7 °С в дигидрат. Получают иодид взаимод. Zn с I2
в водном р-ре с послед. выпариванием и высушиванием. Очищают сублимацией.
Используют как катализатор в орг. синтезе, аналит. реагент, антисептик
в медицине.
Взаимод. Zn с I2 при 1000 °С
под давлением получен моноиодид ZnI черного цвета, быстро окисляющийся
на воздухе.
П. И. Федоров.
|

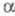 -РbО2;
ур-ние температурной зависимости давления пара lgp (мм рт. ст.)
= 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен,
мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается
горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды
(плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При
гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При
нагр. на воздухе и в токе водяного пара ZnF2 превращается в
ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3
или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2
- материал для лазеров, компонент люминофоров, глазурей, эмалей, спец.
стекол, р-ров для цинкования, консервант для древесины, протрава при крашении.
Токсичен.
-РbО2;
ур-ние температурной зависимости давления пара lgp (мм рт. ст.)
= 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен,
мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается
горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды
(плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При
гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При
нагр. на воздухе и в токе водяного пара ZnF2 превращается в
ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3
или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2
- материал для лазеров, компонент люминофоров, глазурей, эмалей, спец.
стекол, р-ров для цинкования, консервант для древесины, протрава при крашении.
Токсичен.
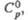 Дж/(моль х К)
Дж/(моль х К)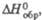 кДж/моль
кДж/моль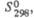 Дж/(моль х К)
Дж/(моль х К)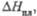 кДж/моль
кДж/моль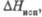 кДж/моль
кДж/моль