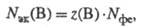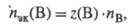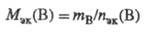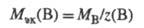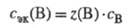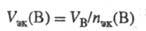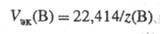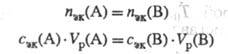Химическая энциклопедия
"ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ"
Главная - Химическая энциклопедия - буква Э - ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ
ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ
,
условная
частица, в целое число раз меньшая (или равная) соответствующей ей формульной
единицы - атома, молекулы, иона, радикала и др. В одной формульной единице
в-ва В может содержаться z(B) Э. х. этого в-ва. Число z(B) (эквивалентное
число) показывает, сколько Э. х. содержится в одной формульной единице;
всегда z(B) nэк(B)=Nэк(B)/NA, где NA - постоянная Авогадро. Единица измерения кол-ва в-ва Э. х.- моль. Так как в одной формульной единице в-ва В может содержаться z(B) Э. х. этого в-ва, то
где Nфе - число формульных единиц в-ва В. Следовательно:
где nв - кол-во в-ва
В.
Значение МЭК(В) можно найти, исходя из молярной массы в-ва В (Мв, г/моль):
Молярная концентрация Э. х. растворенного в - ва В - сЭК(В) представляет собой отношение кол-ва в-ва Э. х. nЭК(В) к объему р-ра Vp: cЭК(B) = nЭК(B)/Vp Единица измерения сЭК(В) - моль/л, обозначение этой единицы - "н." (нормальность - число Э. х. растворенного в-ва в 1 л р-ра). Запись 0,01 н. р-р КМnО4 означает сантинормальный р-р КМnО4. Величина сЭК(В) в конкретной р-ции всегда в z(B) раз больше его молярной концентрации св:
Объем Э. х. газообразного в-ва В - VЭК(B) представляет собой отношение объема данного газа VВ к кол-ву в-ва Э. х. в-ва В:
Единица измерения VЭК(В) - л/моль. Поскольку для газов, принимаемых условно за идеальные, nв = VB/Vn, где Vп = 22,414 л/моль, то
Т. обр., VЭК(B) в конкретной
хим. р-ции, протекающей в нормальных условиях, всегда в z(В) раз меньше
объема 1 моля идеального газа.
Раньше под Э. х. понимали кол-во в-ва, к-рое присоединяет или замещает 1 моль атомов водорода в ходе хим. р-ции. Однако это понятие относится не к самому Э. х., а к кол-ву в-ва Э. х. взятого в-ва В, как это видно из приведенных выше др. физ. величин, связанных с понятием Э. х. Ранее использовали также понятие "грамм-эквивалент", равный Э. х., выраженному в граммах. Лит.: Степин Б. Д., Применение Международной системы единиц физических величин в химии, М., 1990; Степин Б.Д., Цветков А.А., Неорганическая химия, М., 1994. Б. Д. Степин.
|
Поделитесь с друзьями:
Вы можете поставить ссылку на это слово:
будет выглядеть так: ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ
будет выглядеть так: Что такое ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ
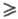 1.
Значения z(В) зависят от хим. р-ции, в к-рой данное в-во участвует.
1.
Значения z(В) зависят от хим. р-ции, в к-рой данное в-во участвует.
 2К3[А1(ОН)6] + 3K2SO4 на одну
формульную единицу A12(SO4)3 затрачивается
12 формульных единиц КОН. Следовательно, значение z[Al2(SO4)3]
= 12, a z(KOH) = 1. Значение Э. х. для A12(SO4)3
равно 1/12 формульной единицы A12(SO4)3,
а Э. х. КОН равен формульной единице КОН. В окислит.-восстановит. р-циях
значение z(B) определяют по числу электронов, к-рые принимает одна формульная
единица окислителя или отдает одна формульная единица восстановителя. Напр.,
в полуреакции
2К3[А1(ОН)6] + 3K2SO4 на одну
формульную единицу A12(SO4)3 затрачивается
12 формульных единиц КОН. Следовательно, значение z[Al2(SO4)3]
= 12, a z(KOH) = 1. Значение Э. х. для A12(SO4)3
равно 1/12 формульной единицы A12(SO4)3,
а Э. х. КОН равен формульной единице КОН. В окислит.-восстановит. р-циях
значение z(B) определяют по числу электронов, к-рые принимает одна формульная
единица окислителя или отдает одна формульная единица восстановителя. Напр.,
в полуреакции значение z
значение z = 5, а значение Э. х. для анионов МnО-4 равно 1/5
формульной единицы
= 5, а значение Э. х. для анионов МnО-4 равно 1/5
формульной единицы